长期以来,采矿、冶炼、印染、电镀等传统工业生产活动一直是环境重金属污染事故频发的主要诱因[1]。镉(cadmium, Cd)是一种生物非必需元素,同时也是环境中一种典型的重金属污染物,其存在隐蔽,扩散性强且极易被生物积累,对地球生态系统稳定和人类身体健康构成了严重威胁[2]。当前,环境Cd污染的修复方法主要为物化法,存在成本高、易造成二次污染等诸多问题。其次,应用较为广泛的还有植物修复法,该技术兼具广谱性和可持续性的特征,在环境Cd污染修复及污染场地的生态恢复中具有较高的应用价值和开发潜力,然而修复过程中植物的耐受性往往会因重金属浓度或处理时间逐渐下降。如张静等[3]发现在低浓度(0.2 mg·L-1)Cd处理下,水芹(Oenanthe javanica)株高和根数无明显变化,而当Cd2+浓度上升至10 mg·L-1时,水芹生长受到了明显的抑制作用,株高、根数和鲜质量都显著减少。龚双姣等[4]报道,低浓度Cd (1 mg·L-1)胁迫即可损伤藓类植物的叶细胞,高浓度Cd(10~100 mg·L-1)胁迫下的叶细胞伤害率大幅上升,光合色素含量显著下降,且其对Cd胁迫的耐受性与体内Cd累积量呈明显的正相关关系。
针对上述问题,近年来关于增强重金属胁迫下植物耐性的研究逐渐成为环境科学领域的研究热点。其中,外源物质诱导增强植物耐性技术凭借应用方式简单、强化效果显著且无二次污染风险等特点[5],广受学者关注。多胺(polyamines, PAs)指具有2个及以上氨基的化合物,是生物生理代谢过程中产生的一种小分子活性脂肪族含氮碱。PAs在植物的生长发育过程中扮演重要角色,如细胞分裂、胚胎发生、生根、种子萌发等,也与植物体内各种激素合成、信号转导、逆境响应等密切相关[6-7]。于是有学者认为PAs是一类新的植物激素。但由于其在植物体内的作用浓度和运输方式与激素存在差异,又被认为是激素的媒介物质,起类似环腺苷酸(cAMP)的“第二信使”作用,或者说PAs是植物生长发育的调节物质。根据其分子结构中氨基数量的不同,可划分为二胺、三胺、四胺等。亚精胺(spermidine, Spd)是植物中存在最为广泛的一种三胺类PAs,作为一种外源植物生长调节物质广泛应用于农田作物的抗逆研究中[8-10]。大量研究表明,PAs对提高植物抗水分、盐碱、温度等胁迫的能力具有重要作用。对于重金属胁迫,外源Spd可以通过螯合重金属离子、清除活性氧自由基(reactive oxygen species, ROS)、调节生物大分子合成代谢及其活性以及稳定细胞膜结构等生物学途径[11],有效缓解重金属对植物的毒害作用,进而影响植物对重金属离子的吸收与积累。
目前,关于外源Spd对重金属胁迫下木本植物生理耐性机制的影响研究较多,Tang等[12]研究发现外施Spd可有效抑制旱柳(Salix matsudana)体内Pb诱导的ROS的生成,提高抗氧化活性物质的含量,并促进了Pb2+在根中的积累。尹泽润等[13]在对杞柳(Salix integra Thunb.)的研究中也得到了类似结果。Gong等[14]则认为,仅在毒害损伤达到一定程度时,Spd对Cd胁迫下生长的灌木属植物苎麻(Boehmeria nivea (L.) Gaudich.)的缓解作用才显著。黑麦草(Lolium perenne Linn.)适应性强、生长快速且生物量大,一直以来都是研究植物重金属耐性或修复重金属(特别是Cd)污染土壤的潜在物种之一[15]。当前关于外源Spd缓解Cd胁迫草本植物的研究还鲜有报道,本研究以一年生黑麦草为受试植物,采用水培的方式,考察在Cd污染条件中添加Spd对黑麦草生理生化的影响,进而探讨Spd对黑麦草生长的缓解效应及其机制,以期为植物环境修复技术的完善提供毒理学方面的借鉴参考。
1 材料与方法(Materials and methods)
1.1 实验材料
化学试剂:CdCl2·2.5 H2O、HNO3和HClO4等均为分析纯,购自天津化学试剂厂;Spd(纯度99%)购自Sigma公司。用去离子水配制1 g·L-1 Cd和100 mmol·L-1 Spd的储备母液,按实验所需的浓度稀释使用。
供试植物及预培养:宽叶型四倍体一年生黑麦草,品种为冬牧-70,种子购自四川惠发牧业有限公司。经3%过氧化氢溶液消毒20 min后,冲洗晾干用温水浸种2 h,挑选20粒颗粒饱满,大小均匀的种子置于水培盒中,放入恒温培养箱中22 ℃条件下避光催芽。3~5 d后待幼苗长至4~6 cm时,将所有试验植株移至植物温室中进行培养,一周后改用1/2×Hoagland营养液继续培养2周,营养液每周更换一次。温室室内条件如下:日温(24±2) ℃,夜温(19±2) ℃,湿度65%~80%,光照强度为5 000~8 000 lx,光照时间为12 h·d-1。
1.2 水培实验
预培养完成后,留下水培盒中生长良好、大小和高度一致的幼苗12株,洗净根系并用吸水纸擦干表面水分后进行水培试验。试验共设6个处理(表1),每个处理设3组平行,Cd和Spd浓度的设定是根据前人[16]研究,结合预实验结果所确定。所有处理培养液均以1/2×Hoagland营养液为基础液配制,体积均为330 mL,并调节pH值为6.5~7.0,每5 d更换一次,共处理10 d。
表1 试验分组
Table 1 Test grouping
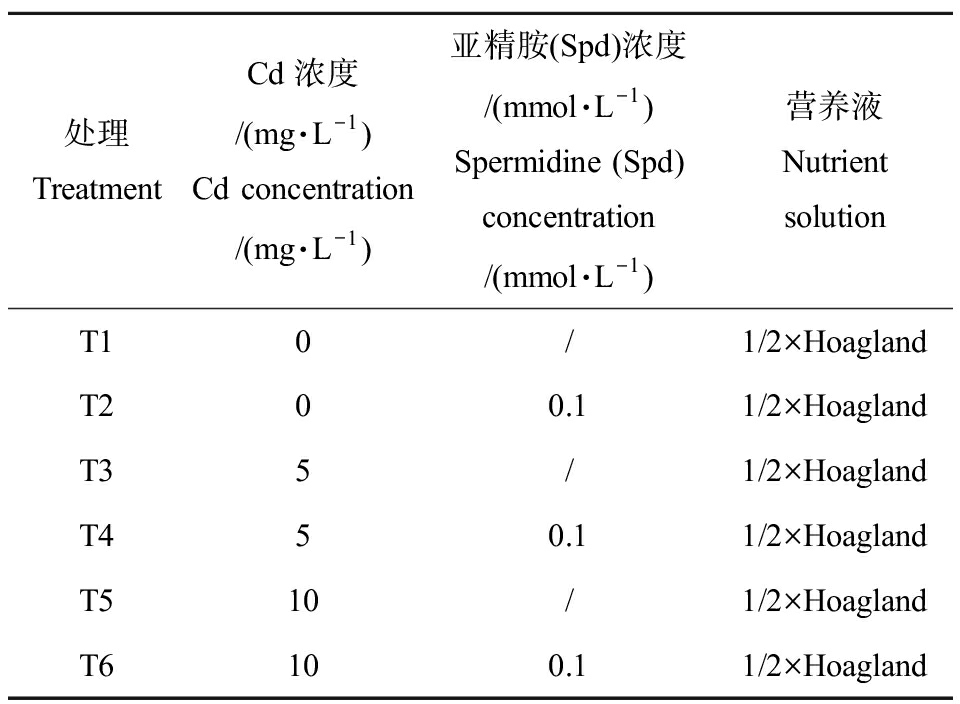
处理TreatmentCd浓度/(mg·L-1)Cd concentration/(mg·L-1)亚精胺(Spd)浓度/(mmol·L-1)Spermidine (Spd) concentration/(mmol·L-1)营养液Nutrient solutionT10/1/2×HoaglandT200.11/2×HoaglandT35/1/2×HoaglandT450.11/2×HoaglandT510/1/2×HoaglandT6100.11/2×Hoagland
1.3 测定指标及方法
试验结束后,将各处理组植株分离为地上部(茎叶)和地下部(根),将根系浸泡在20 mmol·L-1 EDTA溶液中去除附着在根系表面的Cd2+,浸泡15 min后取出,依次用自来水、去离子水冲洗干净,吸干水分。分别测定植株地上部和地下部的鲜质量,然后称取部分叶样品-80 ℃保存用于生理生化指标测定,剩余所有样品105 ℃杀青30 min后,75 ℃烘干至恒重,然后剪碎、磨粉分别测定干质量。采用浸提法[17]测定叶片叶绿素含量;采用曹建康等[18]的方法测定过氧化氢(hydrogen peroxide, H2O2)和丙二醛(malondialdehyde, MDA)含量。参考侯福林[19]的氯化硝基氮蓝四唑法测定超氧化物歧化酶(superoxide dismutase, SOD)活性,过氧化氢酶(catalase, CAT)和过氧化物酶(peroxidase, POD)分别采用紫外吸收法[19]和愈创木酚法[19]测定。抗坏血酸((ascorbic acid, ASA)含量测定参考陈建勋和王晓峰[20]的方法,还原型谷胱甘肽(glutathione, GSH)含量采用南京建成生物工程研究所生产的试剂盒测定。湿灰化法[21]测定植物体内Cd含量,用HNO3-HClO4(体积比3∶1)体系消解,火焰原子吸收光谱仪(AA-6300C,日本岛津)进行测定,按下列公式[22]计算黑麦草对Cd的耐性指数(tolerance index, TI)、富集系数(bioaccumulation factor, BAF)、转运系数(translocation factors, TF)和积累量:
TI = 处理组鲜质量/对照组鲜质量
BAF = 植物地上部Cd含量/培养液中Cd含量
TF = 地上部Cd含量/地下部Cd含量
Cd积累量 = 组织Cd含量×组织干质量
1.4 数据分析
采用软件Excel 2011进行数据处理;采用软件SPSS 25.0对数据进行差异显著性检验(Duncan 多重比较,P<0.05),以及生理指标间的相关性分析;采用软件Origin 9.0进行绘图。文中数据为3组平行试验的平均值,或平均值±标准差。
2 结果(Results)
2.1 外源Spd对Cd胁迫下黑麦草生长及耐性指数的影响
Cd对植物生长最直观的影响通常表现在其生长情况上。如表2所示,相较于T1,T3和T5植株地上部和地下部的生物量和耐性指数均出现了不同程度的下降,且Cd的浓度越高抑制作用越显著。与Cd单独处理相比,外源Spd的添加一定程度上提高了黑麦草的生物量。其中,以T6处理的效果最为显著,地上部与地下部的鲜质量相比T5分别提高了20.04%和22.97%,干质量分别提高了23.12%和19.30%。而T4与T3相比,植株鲜质量和干质量均无显著性差异。由此可见,Spd可以促进植物在重金属胁迫下的生长,且在生长受到严重抑制的情况下作用更为明显。
表2 外源Spd对Cd胁迫下黑麦草生物量的影响
Table 2 Effect of exogenous Spd on the biomass of ryegrass under Cd stress
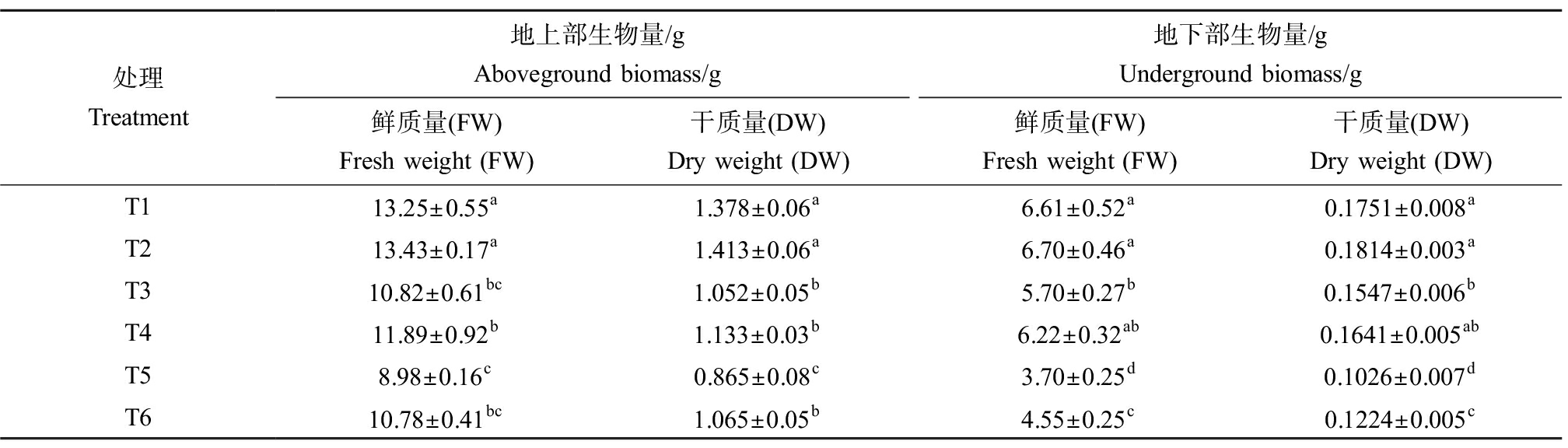
处理Treatment地上部生物量/gAboveground biomass/g地下部生物量/gUnderground biomass/g鲜质量(FW)Fresh weight (FW)干质量(DW)Dry weight (DW)鲜质量(FW)Fresh weight (FW)干质量(DW)Dry weight (DW)T113.25±0.55a1.378±0.06a6.61±0.52a0.1751±0.008aT213.43±0.17a1.413±0.06a6.70±0.46a0.1814±0.003aT310.82±0.61bc1.052±0.05b5.70±0.27b0.1547±0.006bT411.89±0.92b1.133±0.03b6.22±0.32ab0.1641±0.005abT58.98±0.16c0.865±0.08c3.70±0.25d0.1026±0.007dT610.78±0.41bc1.065±0.05b4.55±0.25c0.1224±0.005c
注:不同的小写字母表示处理组间的差异显著。
Note: Different lowercase letters indicate significance of differences between treatment groups.
图1显示的是外源Spd对Cd胁迫下黑麦草耐性指数的影响,其中仅T2组植株的耐性指数>1。随着Cd浓度的升高,耐性指数呈下降趋势,说明此时Cd胁迫严重影响了黑麦草的生长发育。T4和T6植株地上部与地下部的耐性指数均高于只添加Cd的T3和T5植株,其中T6处理的作用最为明显,地上部耐性指数由0.68上升至0.81,地下部由0.56上升至0.69,说明外源Spd处理一定程度上增强了黑麦草对Cd的耐性,改善黑麦草的生长状况。
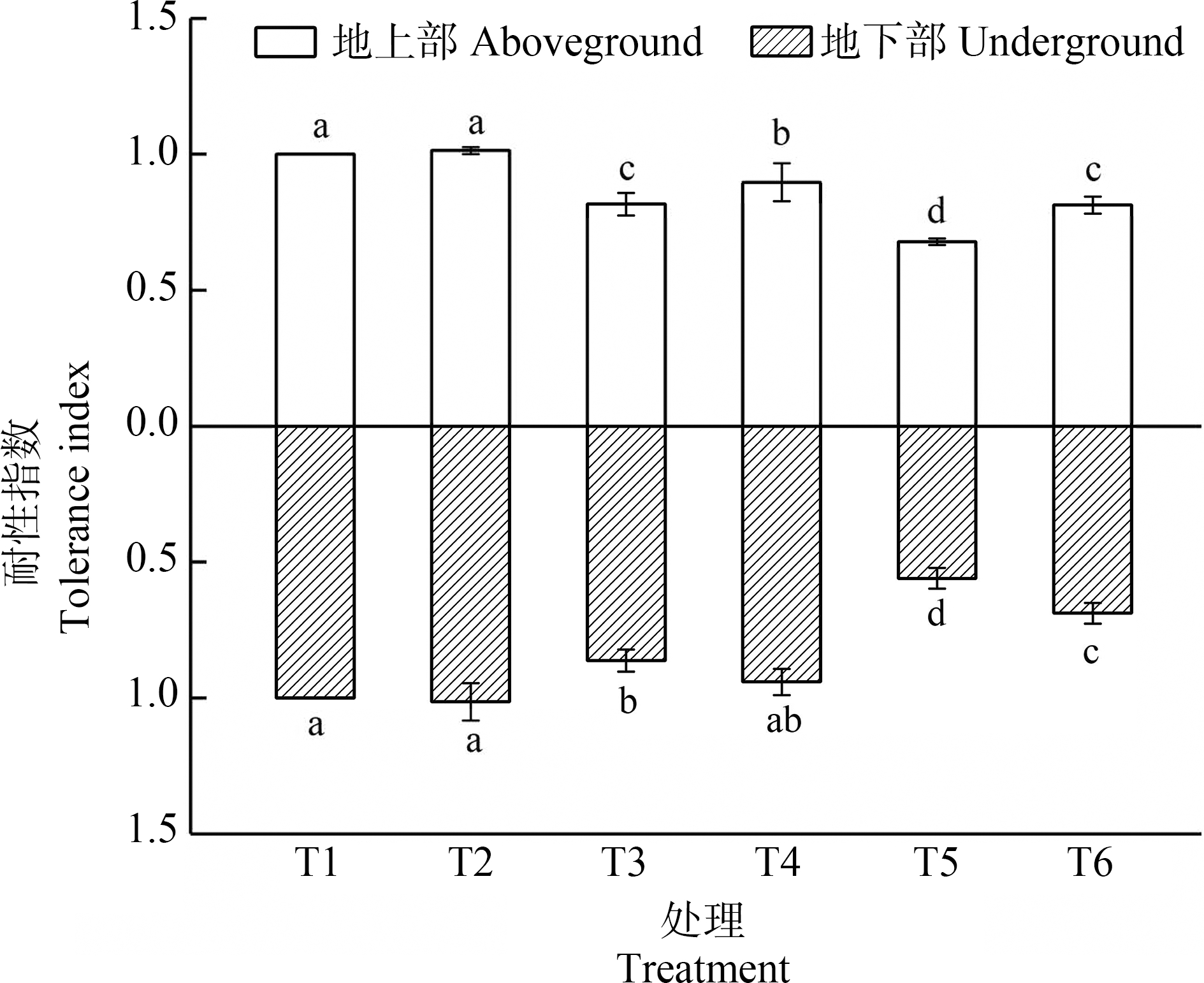
图1 外源Spd对Cd胁迫下黑麦草耐性指数的影响
注:不同的小写字母表示处理组间的差异显著。
Fig. 1 Effect of exogenous Spd on the tolerance index of ryegrass under Cd stress
Note: Different lowercase letters indicate significance of differences between treatment groups.
2.2 外源Spd对Cd胁迫下黑麦草叶绿素的影响
叶绿素是植物进行光合作用的主要色素,其含量的高低与植物生长状况有着极其密切的关系。本研究中,外源Spd对Cd胁迫下黑麦草叶绿素的影响如表3所示。由表3可知,与T1相比,单一Spd处理植株叶绿素(a+b)含量没有显著变化。而当Cd浓度为5 mg·L-1时,黑麦草叶绿素(a+b)含量出现了显著下降,降幅为14.94%,而叶绿素a和叶绿素b含量无显著变化。与之相比,添加Spd的T4处理植株叶绿素(a+b)含量显著上升了15.20%,叶绿素a和叶绿素b分别上升了13.87%和28.57%。当Cd浓度为10 mg·L-1时,与5 mg·L-1 Cd处理相比叶绿素(a+b)含量没有出现加速下降趋势,只有叶绿素a显著下降了6.39%。添加Spd的T6处理植株叶绿素(a+b)、叶绿素a和叶绿素b含量均上升显著,分别提高了28.73%、24.05%和46.11%,这与孙天国和孙玉斌[23]的研究结果类似,其发现高浓度Pb胁迫下喷施一定浓度的Spd可以提高甜瓜(Cucumis melo L.)叶片的叶绿素含量。叶绿素a/b表现出相反的变化趋势,其值随着Cd浓度的上升而上升,并在Cd浓度10 mg·L-1时达到峰值,外源Spd则使其显著下降接近对照组水平。
表3 外源Spd对Cd胁迫下黑麦草叶绿素含量及叶绿素a/b的影响
Table 3 Effect of exogenous Spd on chlorophyll content and chlorophyll a/b of ryegrass under Cd stress
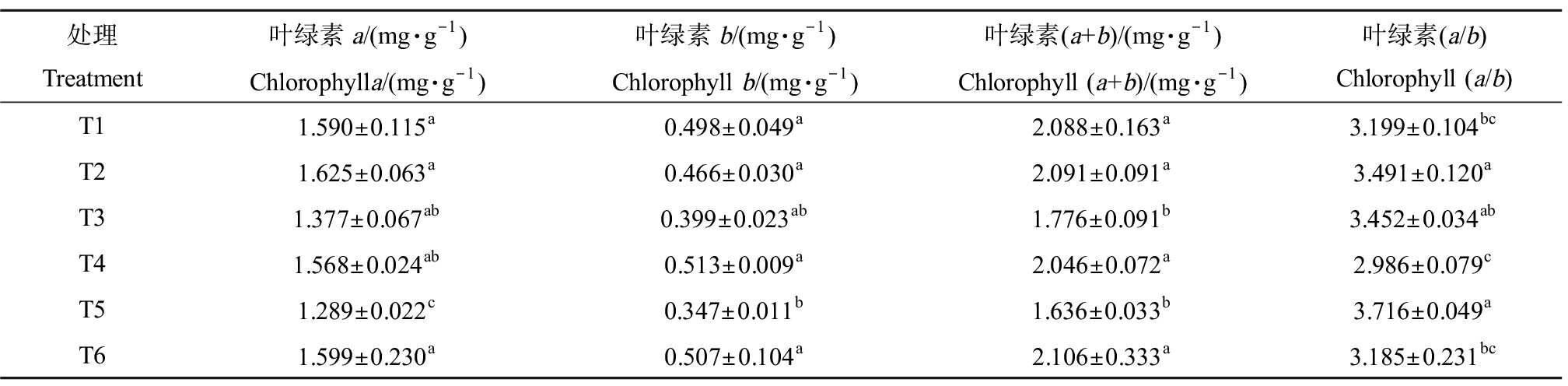
处理Treatment叶绿素a/(mg·g-1)Chlorophylla/(mg·g-1)叶绿素b/(mg·g-1)Chlorophyll b/(mg·g-1)叶绿素(a+b)/(mg·g-1)Chlorophyll (a+b)/(mg·g-1)叶绿素(a/b)Chlorophyll (a/b) T11.590±0.115a0.498±0.049a2.088±0.163a3.199±0.104bcT21.625±0.063a0.466±0.030a2.091±0.091a3.491±0.120aT31.377±0.067ab0.399±0.023ab1.776±0.091b3.452±0.034abT41.568±0.024ab0.513±0.009a2.046±0.072a2.986±0.079cT51.289±0.022c0.347±0.011b1.636±0.033b3.716±0.049aT61.599±0.230a0.507±0.104a2.106±0.333a3.185±0.231bc
注:叶绿素含量以单位鲜质量计;不同的小写字母表示处理组间的差异显著。
Note: Chlorophyll content is calculated based on fresh weight; different lowercase letters indicate significance of differences between treatment groups.
2.3 外源Spd对Cd胁迫下黑麦草MDA和H2O2含量的影响
外源Spd对Cd胁迫下黑麦草叶片MDA和H2O2含量的影响见图2。由图2可知,MDA含量变化具有明显的Cd浓度依赖性,即Cd浓度越高,MDA含量也越高。T1与T2植株间MDA含量无显著性差异,而5 mg·L-1和10 mg·L-1 Cd处理分别使其含量提高了17.34%和84.6%(与T1相比),说明Cd浓度越高,植株叶片膜脂过氧化程度越严重。Spd的加入使叶片MDA含量有一定下降,但只有T6组下降有显著性,降幅为16.73%。随着Cd浓度的上升,H2O2含量也逐渐上升,这与MDA变化趋势一致。Cd浓度为5 mg·L-1时,植株叶片H2O2含量相较T1显著上升了17.31%。添加Spd后,H2O2含量出现了下降,降幅为10.49%(P<0.05)。当Cd浓度为10 mg·L-1时,叶片H2O2含量达到了峰值,与T1相比增加了49.03%(P<0.01),添加Spd使H2O2含量下降了16.45%,但并未达到显著性差异。该结果与前人的研究一致,即通过外施Spd可使重金属胁迫下植物体内MDA和H2O2含量有效降低[24],表明应用Spd可缓解Cd诱导的氧化应激。
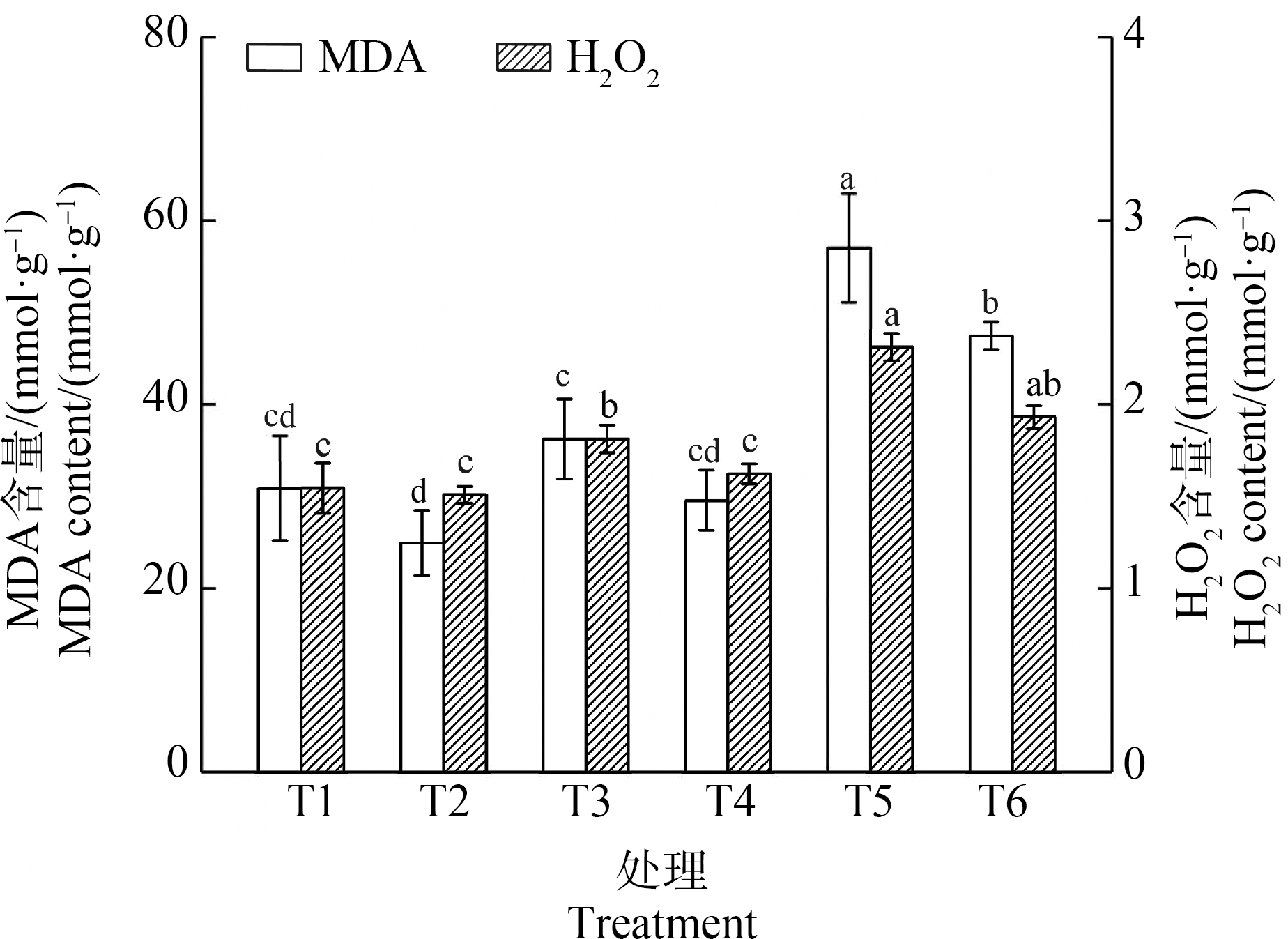
图2 外源Spd对Cd胁迫下黑麦草叶片MDA和H2O2含量的影响
注:MDA含量和H2O2含量均以单位鲜质量计;不同的小写字母表示处理组间的差异显著。
Fig. 2 Effect of exogenous Spd on MDA and H2O2 content of ryegrass leaves under Cd stress
Note: MDA content and H2O2 content are calculated based on fresh weight; different lowercase letters indicate significance of differences between treatment groups.
2.4 外源Spd对Cd胁迫下黑麦草抗氧化酶CAT、POD和SOD活性的影响
外源Spd对黑麦草叶片抗氧化酶CAT、POD和SOD活性的影响如图3所示。Cd胁迫使叶片CAT活性出现了显著下降,与T1相比,T3和T5植株叶片CAT活性分别下降了22.86%和42.50%。仅在Cd浓度为10 mg·L-1时添加Spd,植株叶片CAT的变化才显著,较T5植株上升了44.72%。POD活性的变化有所不同,5 mg·L-1和10 mg·L-1处理分别使POD活性较对照组提高了92.95%和95.61%(P<0.05)。这与林琳等[25]的报道一致,其研究发现Pb胁迫可诱导生菜(Lactuca sativa L.)POD活性的提高。Cd浓度为5 mg·L-1时,应用Spd使POD活性显著下降了11.92%;Cd浓度为10 mg·L-1时应用Spd,POD活性则无显著变化。3种酶中SOD活性的变化最为明显,T3和T5植株SOD活性与T1相比分别下降了55.32%和87.23%。添加Spd对SOD活性的影响同样最为明显,T4和T6植株叶片SOD活性相较对应的T3和T5分别显著上升了41.75%和100.12%。
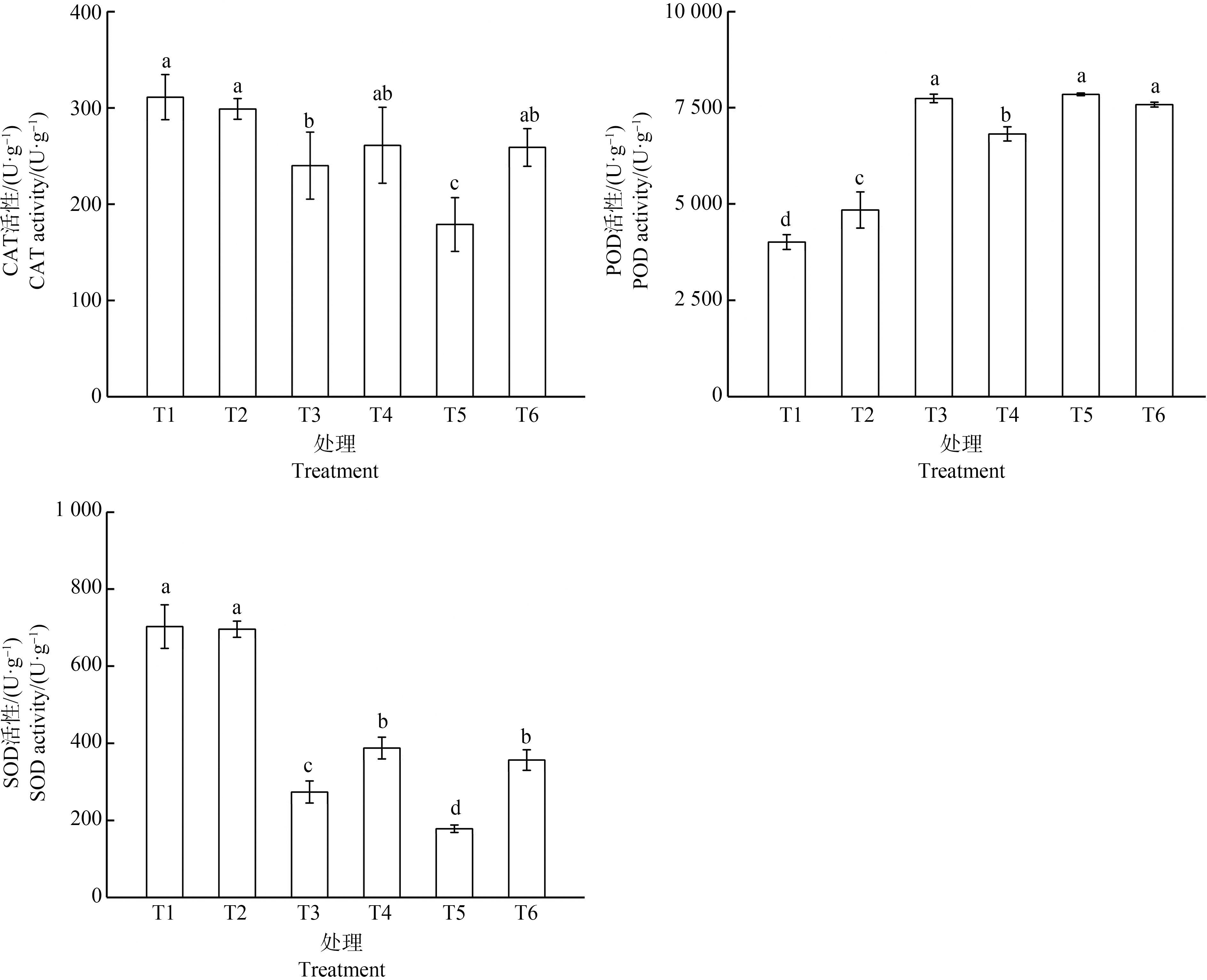
图3 外源Spd对Cd胁迫下黑麦草叶片CAT、POD和SOD活性的影响
注:CAT、POD和SOD活性均以单位鲜质量计;不同的小写字母表示处理组间的差异显著。
Fig. 3 Effect of exogenous Spd on CAT, POD and SOD activities of ryegrass leaves under Cd stress
Note: CAT, POD, and SOD activities are calculated based on fresh weight; different lowercase letters indicate significance of differences between treatment groups.
2.5 外源Spd对Cd胁迫下黑麦草ASA和GSH含量的影响
图4显示的是外源Spd对黑麦草叶片ASA和GSH含量的影响。由图4可知,Cd胁迫下,叶片ASA含量随着Cd浓度的增加先下降后上升。与T1植株相比,T3植株叶片ASA含量下降了21.10%,T5植株上升了119.12%,且两者都存在显著性差异。添加Spd的T4使ASA含量转变为上升49.66%,添加Spd的T6使ASA含量进一步上升了33.84%。GSH含量的变化与ASA略有不同。与T1相比,T3植株叶片GSH含量没有发生显著变化,只有T5处理使叶片GSH含量上升了43.62%(P<0.01)。外源Spd对GSH含量的影响十分有限,仅在5 mg·L-1 Cd处理时添加作用才显著,其含量上升了14.07%。
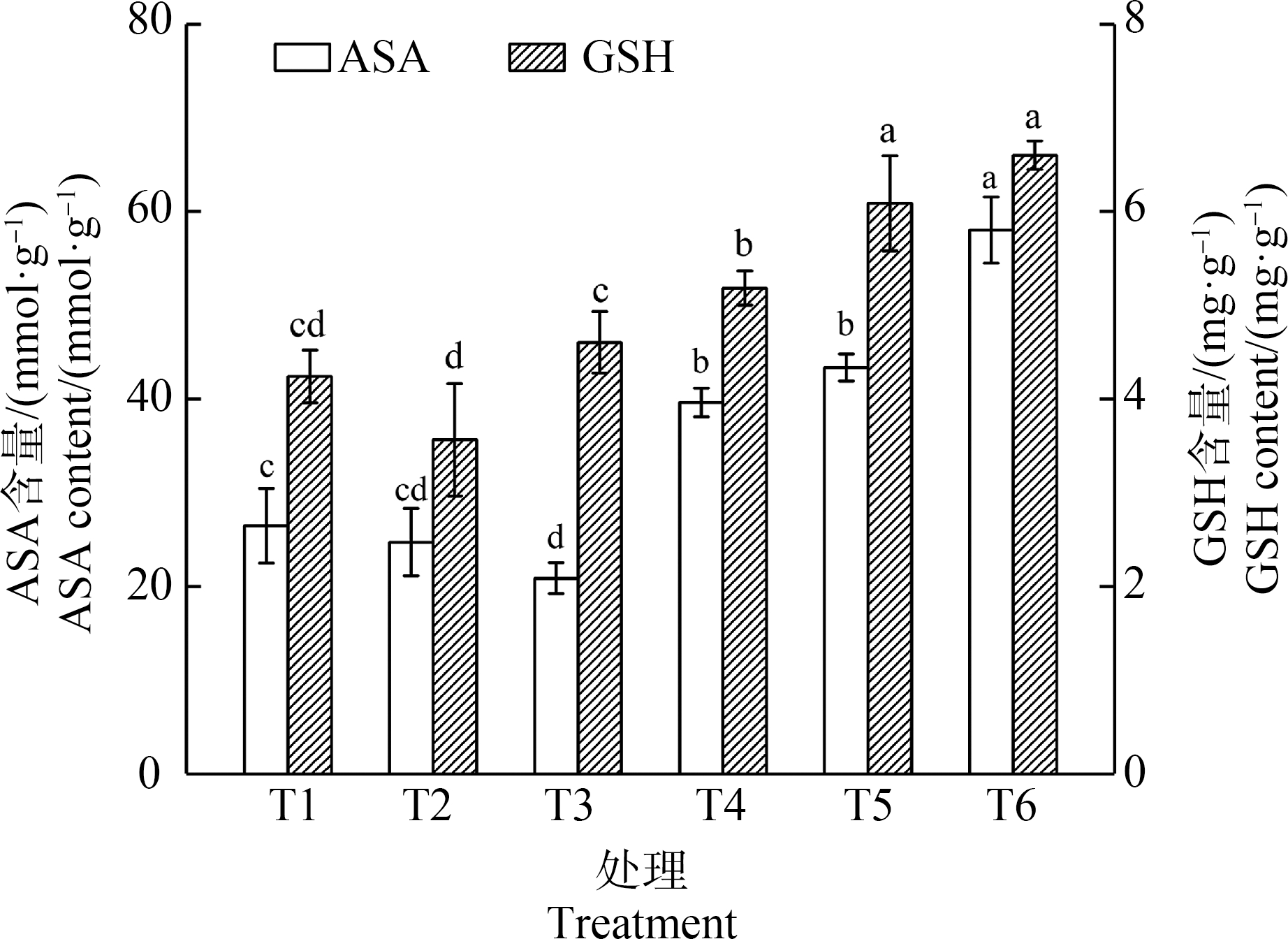
图4 外源Spd对Cd胁迫下黑麦草叶片ASA和GSH含量的影响
注:ASA含量和GSH含量均以单位鲜质量计;不同的小写字母表示处理组间的差异显著。
Fig. 4 Effect of exogenous Spd on ASA and GSH contents of ryegrass leaves under Cd stress
Note: ASA content and GSH content are calculated based on fresh weight; different lowercase letters indicate significance of differences between treatment groups.
2.6 外源Spd对黑麦草Cd积累特征的影响
外源Spd对Cd胁迫下黑麦草Cd含量、富集系数、转运系数和积累量的影响见表4。与大多数重金属富集植物类似,Cd胁迫下黑麦草根系中的Cd含量远远高于其地上部Cd含量,约占植株总Cd含量的92%~93%,这一结果与Li等[26]的研究一致,其研究发现2~10 mg·L-1 Cd胁迫下的苎麻根系中Cd的含量约为地上部分的9倍~10倍。此外,随着Cd处理浓度的上升,黑麦草Cd富集系数、转运系数和积累量均出现不同程度的下降,只有Cd含量在上升。但其并没有随着Cd浓度的增加而呈线性上升趋势,当Cd浓度为10 mg·L-1时,黑麦草地上部和地下部Cd含量较5 mg·L-1处理仅上升了26.99%和37.00%。试验后期该处理植株叶片出现了黄斑和枯萎现象,这表明10 mg·L-1 Cd胁迫可能已接近黑麦草的耐性阈值,其生理机能已受到严重的负面影响,从而导致Cd2+在其体内富集和转运速率减缓。
表4 外源Spd对Cd胁迫下黑麦草Cd含量、富集系数、转运系数和积累量的影响
Table 4 Effect of exogenous Spd on Cd content, enrichment coefficient, transport coefficient and accumulation in ryegrass under Cd stress
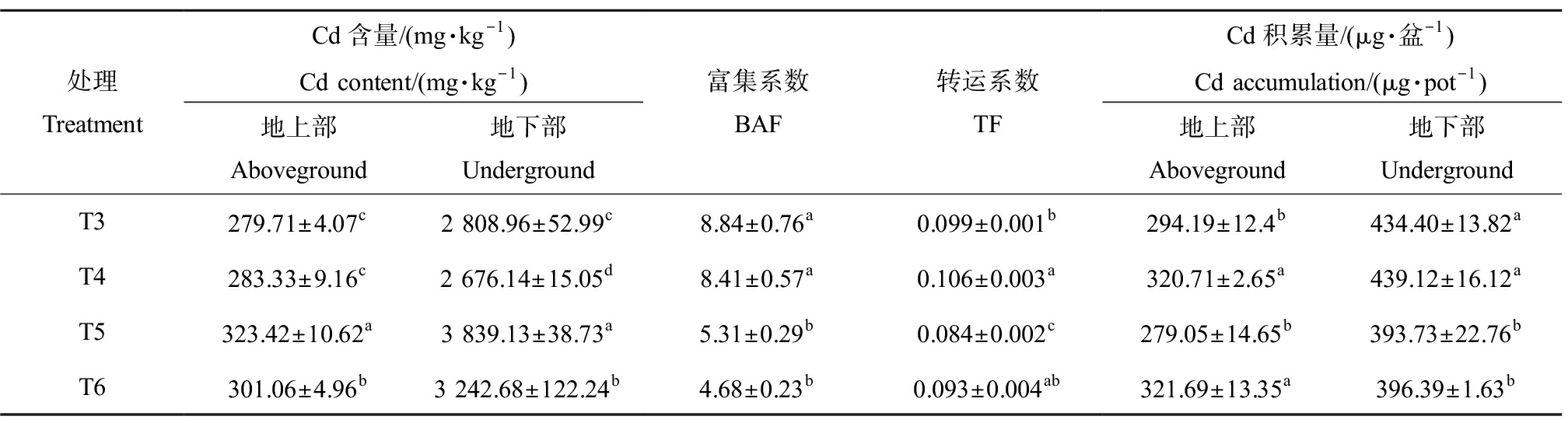
处理TreatmentCd含量/(mg·kg-1)Cd content/(mg·kg-1)地上部Aboveground地下部Underground富集系数BAF转运系数TFCd积累量/(μg·盆-1)Cd accumulation/(μg·pot-1)地上部Aboveground地下部UndergroundT3279.71±4.07c2 808.96±52.99c8.84±0.76a0.099±0.001b294.19±12.4b434.40±13.82aT4283.33±9.16c2 676.14±15.05d8.41±0.57a0.106±0.003a320.71±2.65a439.12±16.12aT5323.42±10.62a3 839.13±38.73a5.31±0.29b0.084±0.002c279.05±14.65b393.73±22.76bT6301.06±4.96b3 242.68±122.24b4.68±0.23b0.093±0.004ab321.69±13.35a396.39±1.63b
注:Cd含量以单位干质量计;不同的小写字母表示处理组间的差异显著。
Note: Cd content is calculated based on dry weight; different lowercase letters indicate significance of differences between treatment groups.
不同浓度的Cd处理下,添加Spd对黑麦草Cd积累的影响不同。当Cd浓度为10 mg·L-1时,添加Spd处理使地上部Cd含量显著下降了6.91%,地下部Cd含量显著下降了15.54%。而当Cd浓度为5 mg·L-1时,添加Spd处理对植株地上部Cd含量无显著影响,仅使地下部Cd含量显著下降了4.73%。Cd转运系数也发生了显著变化,相比5 mg·L-1和10 mg·L-1 Cd单独处理,添加Spd使转运系数分别显著增加了7.07%和10.71%,富集系数均无显著变化。从Cd积累量上来看,地上部和地下部Cd积累量随着Cd浓度的升高均出现了不同程度的下降,外源Spd处理对黑麦草地上部Cd积累量有较为显著的促进作用,相比5 mg·L-1和10 mg·L-1 Cd单独处理,分别提高了8.98%和14.59%,对地下部Cd积累量则无显著影响。
2.7 Cd胁迫与黑麦草生物量以及叶片氧化、抗氧化指标的相关性分析
本研究发现Cd胁迫显著降低了黑麦草生物量、CAT和SOD活性。相关性分析结果见图5(a),溶液中Cd浓度与上述几种指标均负相关,相关系数分别为-1.0、-1.0和-0.94,其中除SOD外,均显著负相关。Cd胁迫还显著提高了黑麦草叶片MDA、H2O2、ASA、GSH含量和POD活性,相关性分析显示与Cd浓度间均呈正相关,相关系数分别为0.95、0.99、0.88、0.72、0.94。外源Spd的应用有效缓解了Cd对黑麦草的伤害作用,增强叶片抗氧化系统,降低氧化产物的含量。添加Spd后,Cd浓度与上述指标间的相关性分析结果见图5(b),CAT和SOD活性虽然和Cd浓度仍呈负相关,但两者的相关系数由-1.0、-0.94下降为-0.89、-0.90。Cd浓度与ASA、GSH含量变为了显著正相关(相关系数均为1.00),与H2O2的相关系数由0.99降为0.97,与POD的相关系数由0.88上升为0.97,上述表明,Spd一定程度上提高了Cd胁迫下黑麦草的抗氧化能力,缓解了Cd的生长抑制作用及其诱导的氧化胁迫伤害。
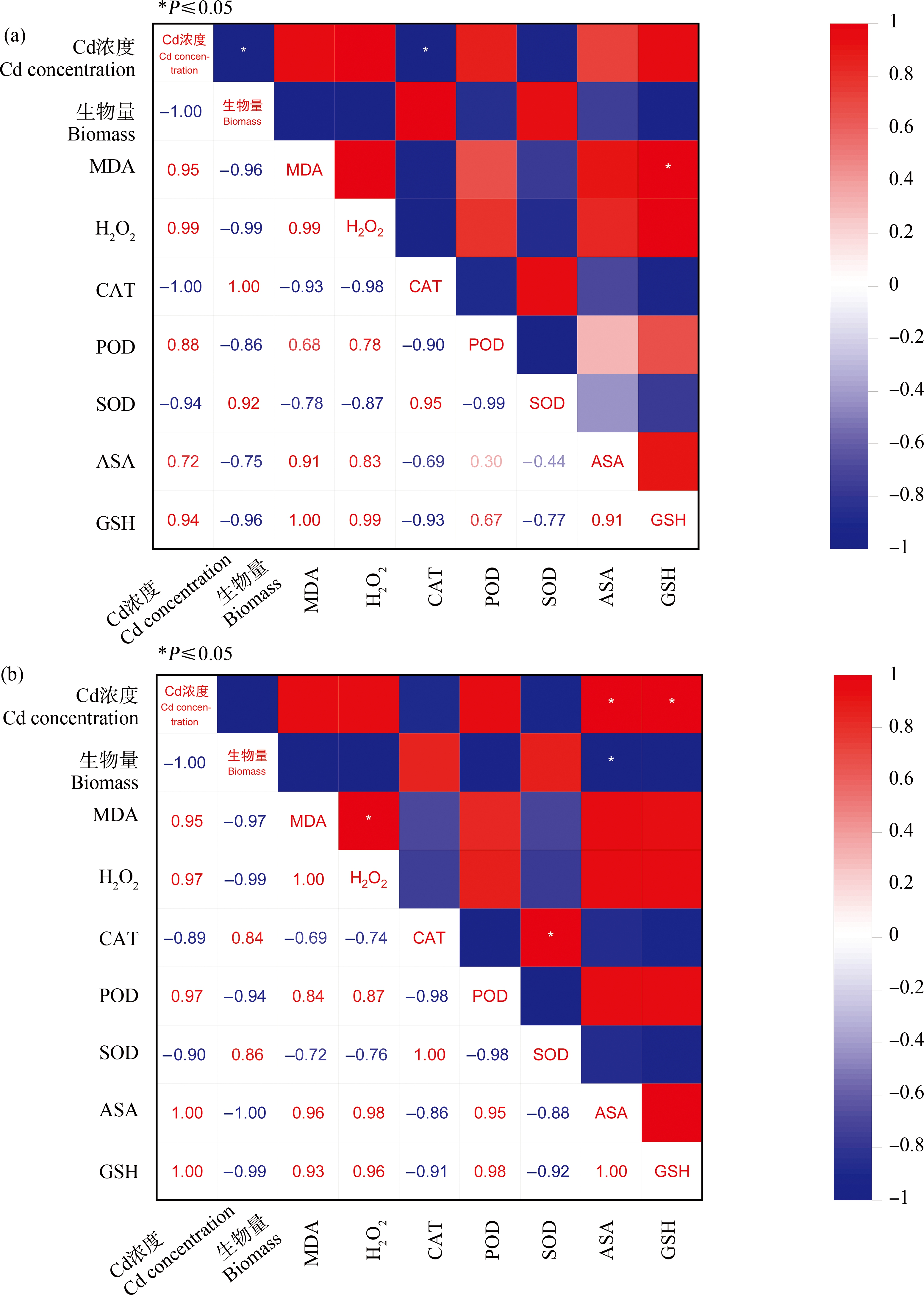
图5 Cd浓度与黑麦草生物量以及叶片氧化、抗氧化指标间的相关性分析
注:(a) 未添加Spd处理(T1、T3和T5),(b) 添加Spd处理(T2、T4和T6)。
Fig. 5 Correlation analysis between Cd concentration and ryegrass biomass, leaf oxidation and antioxidant indexes
Note: (a) Without Spd treatment (T1, T3 and T5), (b) With Spd treatment (T2, T4 and T6).
3 讨论(Discussion)
3.1 外源Spd促进Cd胁迫下黑麦草生长发育及叶绿素合成
Cd是一种生命体非必需元素,一旦进入食物链,会造成难以估量的危害。植物作为食物链的最底层,对生态系统的安全与稳定至关重要。当Cd进入植物体内后会对其生理生化过程产生一系列的影响,最直观的体现在其生物量的变化。本研究发现Cd对黑麦草生物量的影响与前人的研究基本一致,即植物生物量随着Cd处理浓度的增加而减少。Spd的添加提高了Cd胁迫下黑麦草的生物量和耐性指数,但这种效果在10 mg·L-1 Cd处理时才具有显著性,这与Gong等[14]的研究结果一致,其研究发现外源Spd对植物的生长调控作用在胁迫严重时更加明显。Naz等[27]也曾报道,Cr6+胁迫条件下,施用0.1 mmol·L-1 Spd可提高植物株高、地上部鲜质量和叶面积。这与PAs类物质可以参与植物的生长发育和环境胁迫应激相关过程有很大关系[6],因而相比Cd单独处理,Spd与Cd联合处理显著减轻了黑麦草生长受到的负面效应。但同时也存在一些不同的报道,如Groppa等[28]的研究表明,Spd可以作为信号分子促进Cd胁迫下小麦(Triticum aestivum L.)体内NO的形成,抑制小麦根的生长。由此可见,外源Spd对植物生长的调节作用可能会因植物种类的不同而不同。
当Cd2+进入植物叶片后,可取代叶绿素卟啉环中心位置的镁离子,破坏叶绿素分子结构,造成叶片失绿,严重时叶片枯萎[29]。本研究中Cd胁迫显著抑制了黑麦草叶绿素的合成,致使叶绿素a、叶绿素b和叶绿素a+b含量的显著下降,并且与Cd浓度间存在负相关关系,说明Cd可以降低植物的光合能力,这在甘龙等[30]的研究中也得到了证实。从叶绿素a/b的变化趋势可以看出,Cd胁迫下,叶绿素b含量的下降程度要大于叶绿素a,与王建秋等[31]和贾月慧等[32]的研究结果一致。应用Spd后一定程度上逆转了叶绿素a、b、a+b含量和叶绿素a/b的变化趋势,但同样只有在Cd浓度为10 mg·L-1时,添加Spd的作用才显著,其中叶绿素b的响应最为积极,其含量上升了46.11%。Spd可以通过与类囊体膜的相互作用来调节光合器官的结构和功能[33],本研究中叶绿素含量的增加可能与这种作用有关。
3.2 外源Spd上调Cd胁迫下黑麦草叶片抗氧化系统水平
ROS的动态平衡被打破也会引起植物体内抗氧化系统功能的紊乱,致使过量的活性氧物质(主要是一电子还原产物![]() 和二电子还原产物H2O2)不能被及时清除,从而导致细胞膜的脂质过氧化,其产物MDA的含量常用于衡量植物细胞膜脂过氧化程度和对逆境应激反应的强弱。本研究发现,黑麦草叶片MDA和H2O2含量对Cd胁迫的响应较为显著,随着Cd浓度上升而上升,并且均在10 mg·L-1 Cd处理时达到峰值,这也与前述生物量和叶绿素的变化相对应,进一步证实了Cd浓度为10 mg·L-1时对黑麦草生长生理造成了严重伤害。外源Spd在一定程度上降低了这2种物质在叶中的积累,这与前人的研究结果一致。Xu等[34]通过外源添加0.1 mmol·L-1 Spd有效抑制了Cu胁迫下空心莲子草(Alternanthera philoxeroides)的氧化应激,MDA、H2O2和
和二电子还原产物H2O2)不能被及时清除,从而导致细胞膜的脂质过氧化,其产物MDA的含量常用于衡量植物细胞膜脂过氧化程度和对逆境应激反应的强弱。本研究发现,黑麦草叶片MDA和H2O2含量对Cd胁迫的响应较为显著,随着Cd浓度上升而上升,并且均在10 mg·L-1 Cd处理时达到峰值,这也与前述生物量和叶绿素的变化相对应,进一步证实了Cd浓度为10 mg·L-1时对黑麦草生长生理造成了严重伤害。外源Spd在一定程度上降低了这2种物质在叶中的积累,这与前人的研究结果一致。Xu等[34]通过外源添加0.1 mmol·L-1 Spd有效抑制了Cu胁迫下空心莲子草(Alternanthera philoxeroides)的氧化应激,MDA、H2O2和![]() 均显著降低。这是由于Spd本身可以作为一种活性氧清除剂[35],清除由重金属诱导产生的
均显著降低。这是由于Spd本身可以作为一种活性氧清除剂[35],清除由重金属诱导产生的![]() 等物质。Spd还可作为质膜完整性的保护剂,其在生理pH下高度质子化,有利于与膜和蛋白质的负电荷官能团的静电结合,维持膜的稳定性和通透性,缓解细胞质膜的脂质过氧化,从而使MDA含量下降[34]。
等物质。Spd还可作为质膜完整性的保护剂,其在生理pH下高度质子化,有利于与膜和蛋白质的负电荷官能团的静电结合,维持膜的稳定性和通透性,缓解细胞质膜的脂质过氧化,从而使MDA含量下降[34]。
Cd在诱导氧化胁迫产生的同时,也会引起植物自我保护系统的应激反应,其中最重要也是最被人熟知的是抗氧化系统的响应,主要体现在抗氧化酶活性及一些非酶抗氧化剂含量的变化。本研究中,Cd胁迫对黑麦草CAT、POD和SOD活性均产生了显著影响,其中CAT和SOD的活性随着Cd浓度的上升逐渐降低,POD活性则表现为显著上升,这是因为它既可以与其他抗氧化酶一样消除植物体内的ROS,又能在细胞壁内促进产生更多毒性更强的![]() 外源Spd对3种抗氧化酶的影响有所不同,与单一Cd处理组相比,Cd联合Spd处理显著提高了CAT和SOD的活性,这是由于Spd一方面可以参与蛋白质的合成,通过增加酶的数量来参与酶活性的调节。另一方面也可以直接与酶分子结合,稳定蛋白结构和功能,阻止蛋白降解,从而提高单位酶的活性[37]。Spd对POD活性的影响有限,仅在5 mg·L-1 Cd处理时添加,才使POD活性显著下降,可能是由于外施Spd抑制了Cd诱导的POD活性升高,避免POD催化产生的
外源Spd对3种抗氧化酶的影响有所不同,与单一Cd处理组相比,Cd联合Spd处理显著提高了CAT和SOD的活性,这是由于Spd一方面可以参与蛋白质的合成,通过增加酶的数量来参与酶活性的调节。另一方面也可以直接与酶分子结合,稳定蛋白结构和功能,阻止蛋白降解,从而提高单位酶的活性[37]。Spd对POD活性的影响有限,仅在5 mg·L-1 Cd处理时添加,才使POD活性显著下降,可能是由于外施Spd抑制了Cd诱导的POD活性升高,避免POD催化产生的![]() 的过度积累。李阳[38]也有类似发现,其报道了外施0.1 mmol·L-1 Spd可以有效逆转Zn胁迫下水花生(Alternanthera philoxeroides (Mart.) Griseb.)POD活性的上升。除了抗氧化酶外,ASA和GSH等内源小分子抗氧化剂也是植物抗氧化系统的重要组成部分。本研究中仅5 mg·L-1 Cd处理时,植株叶片ASA含量相较对照组显著下降,而GSH含量在所有Cd处理组中均有所上升。外施Spd对ASA和GSH的影响一致,均进一步增加了黑麦草叶片中两者的含量,这与Spd能够提高抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性有直接关联[37]。APX和GR分别是ASA和GSH合成代谢的关键酶,两者活性的提高是ASA和GSH含量上升的主导因素。
的过度积累。李阳[38]也有类似发现,其报道了外施0.1 mmol·L-1 Spd可以有效逆转Zn胁迫下水花生(Alternanthera philoxeroides (Mart.) Griseb.)POD活性的上升。除了抗氧化酶外,ASA和GSH等内源小分子抗氧化剂也是植物抗氧化系统的重要组成部分。本研究中仅5 mg·L-1 Cd处理时,植株叶片ASA含量相较对照组显著下降,而GSH含量在所有Cd处理组中均有所上升。外施Spd对ASA和GSH的影响一致,均进一步增加了黑麦草叶片中两者的含量,这与Spd能够提高抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性有直接关联[37]。APX和GR分别是ASA和GSH合成代谢的关键酶,两者活性的提高是ASA和GSH含量上升的主导因素。
3.3 外源Spd调控黑麦草吸收积累Cd
黑麦草根中富集了大量的Cd,其含量约为地上部的10倍~12倍。Spd显著影响了Cd在黑麦草体内的积累特征,虽然地上部和地下部Cd含量相较单一Cd处理均有所下降,但Cd的转运系数显著上升了7.07% (5 mg·L-1 Cd)和10.71% (10 mg·L-1 Cd),地上部Cd积累量分别上升了8.98% (5 mg·L-1 Cd)和14.59% (10 mg·L-1 Cd)。这可能与PAs类物质具有螯合重金属离子形成复杂复合物的特性有关,例如Cd2+和Hg2+可以和PAs结合形成Cd2+/Hg2+卤化物或伪卤化物-PAs复合体,Cu2+/Ni2+可以和PAs结合形成Cu2+/Ni2+-多聚羧酸复合体[39]。而外源PAs类物质可以促进植物叶片内源PAs水平的上升也被一些学者的研究证实,如Tang等[16]研究发现,外源Spd可诱导Cd胁迫下旱柳叶片内源Spd水平的上升,同时伴随着抗氧化系统和Cd富集转运能力的增强。Shevyakova等[40]的研究表明,植物内源PAs水平的升高有助于与重金属离子的螯合,促进重金属离子向地上部的运输,并可能增强其在液泡和细胞间隙中的区隔化作用,从而降低重金属的毒性。上述表明外源Spd存在通过提高植物内源PAs水平来间接增强植物耐性和重金属转运积累能力的可能,另外本研究中外源Spd的应用缓解了Cd对黑麦草的生长抑制作用,致使生物量有所增加,从而导致体内Cd含量有所降低。或者说这是质变对量变产生的一种负反馈结果,即单位质量植物组织中Cd含量越高,植物本身收到的伤害也就会更大,导致生物量急剧下降,此时Cd含量高的部位中积累量反而没有增加。
综上所述,植物形态学变化是植物应答Cd胁迫的终端体现,这种变化虽然比较直观,通常却滞后于生理反应。植物面临Cd胁迫时,耐性生理指标普遍存在一个变化过程,低于耐性阈值时,水平上升;超过阈值后,水平下降,但会随着处理时间和植物种类等因素的不同而不同。本研究发现水培试验条件下,外源添加Spd处理缓解了Cd对黑麦草的负面作用,显著提高了植株的生物量以及耐性指数,尤其是在10 mg·L-1 Cd胁迫时添加,其促进作用更为显著,同时,叶片中叶绿素含量、抗氧化酶(CAT和SOD)活性和ASA含量也均显著升高,对POD活性和GSH含量的调控作用不明显。与之对应的是,MDA和H2O2的生成受到了抑制,表明Spd使黑麦草对Cd诱导的氧化胁迫的抵御能力有所增强。此外,Cd在黑麦草体内的积累分布情况也有所变化。外源添加Spd使黑麦草体内Cd含量有所下降,但显著提高了Cd的积累量和向地上部的转运。转运系数分别显著上升了7.07%和10.71%,积累量为相应Cd单独处理组植株的1.09倍和1.15倍。本研究表明,外源物质Spd可以通过促进Cd胁迫下植物的生长和调控抗氧化系统,来增强植物对重金属污染环境的耐受性,进而影响Cd2+在植物体内的积累分布。
[1] 曹钰, 宋晓曦. 采矿区土壤重金属污染现状及检测方法研究[J]. 世界有色金属, 2022(16): 90-92
Cao Y, Song X X. Study on the status quo and detection methods of heavy metal pollution in soil of mining area [J]. World Nonferrous Metals, 2022(16): 90-92 (in Chinese)
[2] 宋兰萍, 徐晓阳, 洪婉悦, 等. 镉耐性菌对黑麦草生长特性及镉吸收的影响[J]. 中国环境科学, 2023, 43(3): 1386-1396
Song L P, Xu X Y, Hong W Y, et al. Effect of cadmium-tolerant bacteria on Lolium perenne growth and its cadmium enrichment [J]. China Environmental Science, 2023, 43(3): 1386-1396 (in Chinese)
[3] 张静, 赵秀侠, 汪翔, 等. 重金属镉(Cd)胁迫对水芹生长及生理特性的影响[J]. 植物生理学报, 2015, 51(11): 1969-1974
Zhang J, Zhao X X, Wang X, et al. Effects of cadmium stress on the growth and physiological property of Oenanthe javanic [J]. Plant Physiology Journal, 2015, 51(11): 1969-1974 (in Chinese)
[4] 龚双姣, 马陶武, 李菁, 等. 镉胁迫下三种藓类植物的细胞伤害及光合色素含量的变化[J]. 应用生态学报, 2010, 21(10): 2671-2676
Gong S J, Ma T W, Li J, et al. Leaf cell damage and changes in photosynthetic pigment contents of three moss species under cadmium stress [J]. Chinese Journal of Applied Ecology, 2010, 21(10): 2671-2676 (in Chinese)
[5] 曾小英, 康小虎, 李师翁. 生长调节物质在重金属污染植物中的应用研究进展[J]. 环境科学与技术, 2016, 39(1): 32-37
Zeng X Y, Kang X H, Li S W. Research advance in effect and application of plant growth regulators in plants grown on heavy metals contamination soil [J]. Environmental Science &Technology, 2016, 39(1): 32-37 (in Chinese)
[6] Gonzalez M E, Jasso-Robles F I, Flores-Hernández E, et al. Current status and perspectives on the role of polyamines in plant immunity [J]. Annals of Applied Biology, 2021, 178(2): 244-255
[7] Tiburcio A F, Alcázar R. Potential applications of polyamines in agriculture and plant biotechnology [J]. Methods in Molecular Biology, 2018, 1694: 489-508
[8] Gao J S, Zhuang S Y, Zhang Y H, et al. Exogenously applied spermidine alleviates hypoxia stress in Phyllostachys praecox seedlings via changes in endogenous hormones and gene expression [J]. BMC Plant Biology, 2022, 22(1): 200
[9] Islam M A, Pang J H, Meng F W, et al. Putrescine, spermidine, and spermine play distinct roles in rice salt tolerance [J]. Journal of Integrative Agriculture, 2020, 19(3): 643-655
[10] Liu Y, Zhang J M, Huang B R. Priming effects of phytometabolites and hormones on rooting characteristics in tall fescue exposed to water stress [J]. Crop Science, 2020, 60(5): 2732-2743
[11] 史广宇, 余志强, 施维林. 植物修复土壤重金属污染中外源物质的影响机制和应用研究进展[J]. 生态环境学报, 2021, 30(3): 655-666
Shi G Y, Yu Z Q, Shi W L. Research progress on mechanism and application of exogenous substances in phytoremediation of heavy metal contaminated soil [J]. Ecology and Environmental Sciences, 2021, 30(3): 655-666 (in Chinese)
[12] Tang C F, Song J F, Hu X, et al. Exogenous spermidine enhanced Pb tolerance in Salix matsudana by promoting Pb accumulation in roots and spermidine, nitric oxide, and antioxidant system levels in leaves [J]. Ecological Engineering, 2017, 107: 41-48
[13] 尹泽润, 诸葛玉平, 娄燕宏, 等. 亚精胺对镉胁迫下杞柳生长和生理特性的影响[J]. 农业环境科学学报, 2019, 38(10): 2306-2312
Yin Z R, Zhuge Y P, Lou Y H, et al. Effects of spermidine on growth and physiological characteristics of Salix integra under cadmium stress [J]. Journal of Agro-Environment Science, 2019, 38(10): 2306-2312 (in Chinese)
[14] Gong X M, Liu Y G, Huang D L, et al. Effects of exogenous calcium and spermidine on cadmium stress moderation and metal accumulation in Boehmeria nivea (L.) Gaudich [J]. Environmental Science and Pollution Research International, 2016, 23(9): 8699-8708
[15] Shi G Y, Yan Y J, Yu Z Q, et al. Modification-bioremediation of copper, lead, and cadmium-contaminated soil by combined ryegrass (Lolium multiflorum Lam.) and Pseudomonas aeruginosa treatment [J]. Environmental Science and Pollution Research International, 2020, 27(30): 37668-37676
[16] Tang C F, Zhang R Q, Hu X J, et al. Exogenous spermidine elevating cadmium tolerance in Salix matsudana involves cadmium detoxification and antioxidant defense [J]. International Journal of Phytoremediation, 2019, 21(4): 305-315
[17] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 74-77
[18] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 116-148
[19] 侯福林. 植物生理学实验教程[M]. 2版. 北京: 科学出版社, 2010: 13-101
[20] 陈建勋, 王晓峰. 植物生理学实验指导[M]. 2版. 广州: 华南理工大学出版社, 2006: 24-25
[21] 陈颢, 张继光, 付开林, 等. 火焰原子吸收光谱法中湿法消解和干灰化前处理法测定三七中总铅和铬含量的比较[J]. 现代仪器, 2011, 17(5): 55-58
Chen H, Zhang J G, Fu K L, et al. Comparison of wet digestion and dry ash pretreatment methods for the determination of lead and chromium content in pseudo-ginseng by FAAS [J]. Modern Instruments, 2011, 17(5): 55-58 (in Chinese)
[22] Chen L, Long X H, Zhang Z H, et al. Cadmium accumulation and translocation in two Jerusalem artichoke (Helianthus tuberosus L.) cultivars [J]. Pedosphere, 2011, 21(5): 573-580
[23] 孙天国, 孙玉斌. 外源亚精胺对镉胁迫下玉米幼苗抗氧化酶系统的影响[J]. 种子, 2019, 38(9): 77-80
Sun T G, Sun Y B. The effect of exogenous spermidine on antioxidant enzyme system of mazie seedlings under cadmium stress [J]. Seed, 2019, 38(9): 77-80 (in Chinese)
[24] 孙天国, 孙玉斌. 外源亚精胺对铅胁迫下甜瓜幼苗抗氧化代谢的调控效应[J]. 北方园艺, 2020(4): 42-46
Sun T G, Sun Y B. Regulating effect of exogenous spermidine on antioxidant metabolism of melon seedlings under Pb stress [J]. Northern Horticulture, 2020(4): 42-46 (in Chinese)
[25] 林琳, 旦增卓嘎, 吴玲玲. 铅、镉单一及复合胁迫对生菜幼苗抗氧化酶及亚细胞结构的毒性效应[J]. 生态毒理学报, 2022, 17(2): 337-348
Lin L, Tenzin D, Wu L L. Toxicity of single and combined Pb and Cd stress on antioxidant enzymes and subcellular structure of lettuce [J]. Asian Journal of Ecotoxicology, 2022, 17(2): 337-348 (in Chinese)
[26] Li H Y, Liu Y G, Zeng G M, et al. Enhanced efficiency of cadmium removal by Boehmeria nivea (L.) Gaud. in the presence of exogenous citric and oxalic acids [J]. Journal of Environmental Sciences, 2014, 26(12): 2508-2516
[27] Naz R, Sarfraz A, Anwar Z, et al. Combined ability of salicylic acid and spermidine to mitigate the individual and interactive effects of drought and chromium stress in maize (Zea mays L.) [J]. Plant Physiology and Biochemistry, 2021, 159: 285-300
[28] Groppa M D, Rosales E P, Iannone M F, et al. Nitric oxide, polyamines and Cd-induced phytotoxicity in wheat roots [J]. Phytochemistry, 2008, 69(14): 2609-2615
[29] Grajek H, Rydzyński D, ![]() A, et al. Cadmium ion-chlorophyll interaction—Examination of spectral properties and structure of the cadmium-chlorophyll complex and their relevance to photosynthesis inhibition [J]. Chemosphere, 2020, 261: 127434
A, et al. Cadmium ion-chlorophyll interaction—Examination of spectral properties and structure of the cadmium-chlorophyll complex and their relevance to photosynthesis inhibition [J]. Chemosphere, 2020, 261: 127434
[30] 甘龙, 罗玉红, 李晓玲, 等. Cd胁迫下一年蓬的生长、Cd积累及叶绿素荧光特性[J]. 武汉大学学报(理学版), 2018, 64(1): 70-78
Gan L, Luo Y H, Li X L, et al. Growth, Cd accumulation, and chlorophyll fluorescence characteristic of Erigeron annuus under Cd stress [J]. Journal of Wuhan University (Natural Science Edition), 2018, 64(1): 70-78 (in Chinese)
[31] 王建秋, 曹子林, 王晓丽, 等. 铅胁迫对滇白前生长、光合作用及叶绿素荧光的影响[J]. 草地学报, 2021, 29(11): 2422-2427
Wang J Q, Cao Z L, Wang X L, et al. Effects of lead stress on growth, photosynthetic physiology and chlorophyll fluorescence of Silene viscidula [J]. Acta Agrestia Sinica, 2021, 29(11): 2422-2427 (in Chinese)
[32] 贾月慧, 韩莹琰, 刘杰, 等. 生菜对镉胁迫的生理响应及体内镉的累积分布[J]. 农业环境科学学报, 2018, 37(8): 1610-1618
Jia Y H, Han Y Y, Liu J, et al. Physiological adaptations to cadmium stresses and cadmium accumulation in lettuce [J]. Journal of Agro-Environment Science, 2018, 37(8): 1610-1618 (in Chinese)
[33] Yiu J C, Liu C W, Fang D Y, et al. Waterlogging tolerance of Welsh onion (Allium fistulosum L.) enhanced by exogenous spermidine and spermine [J]. Plant Physiology and Biochemistry, 2009, 47(8): 710-716
[34] Xu X Y, Shi G X, Ding C X, et al. Regulation of exogenous spermidine on the reactive oxygen species level and polyamine metabolism in Alternanthera philoxeroides (Mart.) Griseb under copper stress [J]. Plant Growth Regulation, 2011, 63(3): 251-258
[35] 刘书锦, 黄益宗, 保琼莉, 等. 外源亚精胺对 As5+胁迫下水稻种子萌发和As吸收积累的影响[J]. 环境科学, 2020, 41(3): 1505-1512
Liu S J, Huang Y Z, Bao Q L, et al. Effects of exogenous spermidine on seed germination and As uptake and accumulation of rice under As5+ stress [J]. Environmental Science, 2020, 41(3): 1505-1512 (in Chinese)
[36] 王学, 徐恒戬. 精胺对荇菜抗氧化酶系汞毒害的缓解作用[J]. 生态学杂志, 2008, 27(10): 1744-1748
Wang X, Xu H J. Mitigation effects of spermine on Hg injury of Nymphoides peltatum’s antioxidant enzyme system [J]. Chinese Journal of Ecology, 2008, 27(10): 1744-1748 (in Chinese)
[37] 王红霞, 胡金朝, 施国新, 等. 外源多胺对铜胁迫下水鳖叶片多胺代谢、抗氧化系统和矿质营养元素的影响[J]. 生态学报, 2010, 30(10): 2784-2792
Wang H X, Hu J Z, Shi G X, et al. Effects of exogenous polyamines on polyamines metabolism, antioxidative systems and mineral nutrition responses of Hydrocharis dubia (Bl.) Backer under Cu stress [J]. Acta Ecologica Sinica, 2010, 30(10): 2784-2792 (in Chinese)
[38] 李阳. 多胺对水生植物重金属胁迫的缓解效应及机理研究[D]. 南京: 南京师范大学, 2009: 51
Li Y. Study on the alleviative effect and mechanism of polyamines on heavy metal stress in aquatic plants [D].Nanjing: Nanjing Normal University, 2009: 51 (in Chinese)
[39] Satapathi S, Choubey S, Bhar K, et al. A set of new coordination compounds of cadmium(Ⅱ)/mercury(Ⅱ) halides/pseudohalides containing polyamines: Syntheses involving in situ metal-ligand reactions, crystal structures and molecular properties [J]. Inorganica Chimica Acta, 2012, 384: 37-46
[40] Shevyakova N I, Il’ina E N, Stetsenko L A, et al. Nickel accumulation in rape shoots (Brassica napus L.) increased by putrescine [J]. International Journal of Phytoremediation, 2011, 13(4): 345-356