塑料是人类社会重要的人工合成材料之一,通常是由有机聚合物和一些化学添加剂合成的一种高分子有机材料[1],其广泛地应用于我们的日常生活中。从自来水的输送管道到食品饮料的包装材料,都使用了塑料。在这些塑料制品的使用过程中或者废弃后,常规尺寸的塑料材料会因为物理、化学或者生物的作用降解产生微米尺寸的微塑料[2],这些微塑料还可能会进一步降解产生纳米尺寸的纳塑料[3-5]。除了常规尺寸塑料会带来环境污染问题,微/纳塑料也已经成为了一种新污染物,其带来的环境污染和人体健康危害问题也逐渐受到人们的重视。目前已经在多种环境介质(水体[6]、土壤[7]、空气[8])中都检测到了微/纳塑料的存在。饮食被认为是人体摄入微/纳塑料的主要途径[9],在饮用水中[10-12]、人类日常食用的食物中[13-15]以及海鲜中[3, 16]都发现了它们的踪迹。值得注意的是,微塑料已经在人类粪便样本中被检测到[17-18]。这些研究表明微/纳塑料可以被人类摄入。摄入的微/纳塑料会不可避免地与肠道接触,但是其对肠道的毒性效应还不清楚。
肠道上皮表面积约400 m2,是人体最大的黏膜表面[19]。肠道上皮表面由许多细胞组成,包括分泌黏液的杯状细胞,产生激素的肠内分泌细胞,产生抗菌肽的板状细胞以及协调免疫反应的免疫细胞等[20]。这些上皮细胞构成了肠腔与内部环境之间的第一道防线[21]。巨噬细胞是存在于肠道组织中重要的免疫细胞,它以多种方式对进入肠道组织的病原体或外源颗粒物作出反应来协调免疫反应,对于维持肠道组织稳态和调节肠道上皮屏障的完整性具有重要作用[22]。大量研究表明,刺激巨噬细胞发生不良反应是微/纳米材料普遍的一种生物学效应,如:PM2.5 [23]、TiO2 [24]和SiO2 [25]。近期,Gu等[26]发现微塑料导致成年斑马鱼肠道组织中M1型巨噬细胞比例上升,M2型巨噬细胞比例下降。另外,Hwang等[27]报道了微塑料可以增强小鼠巨噬细胞RAW264.7潜在的超敏反应。这些研究提示巨噬细胞可能是微/纳塑料在肠道中的作用靶细胞之一,但是目前针对微/纳塑料对巨噬细胞生物学功能影响的研究有限。
本研究采用3 μm和75 nm这2种尺寸的聚苯乙烯微球分别作为微塑料和纳塑料的模型,采用蛋白组学的方法对微塑料和纳塑料暴露后RAW264.7细胞内差异表达蛋白质进行分析,进一步通过对差异表达蛋白质进行GO(gene ontology)和KEGG(kyoto encyclopedia of gene and genomes)功能注释及功能富集分析,探究M/NP对巨噬细胞生物学功能的潜在影响。
1 材料与方法(Materials and methods)
1.1 微塑料和纳塑料表征
采用透射电镜(TEM,荷兰FEI公司,Tecnai G2 F30 S-Twin)表征3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料的形貌特征以及在培养基中的分散状态。样品的水力直径和粒度分布采用马尔文智能激光粒度仪(英国,Mastersizer 3000)进行表征分析。傅里叶变换红外光谱(FTIR,美国赛默飞世尔科技公司,Thermo Scientific Nicolet iS5)分析3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料的组成成分。本研究所使用的聚苯乙烯微塑料和纳塑料均购买于赛默飞世尔科技(中国)有限公司。
1.2 细胞培养与暴露
本实验使用的细胞系为小鼠巨噬细胞RAW264.7细胞,该细胞购自中国科学院典型培养物保藏委员会细胞库(上海,中国)。RAW264.7细胞用高糖培养基DMEM(Gibco,英国)进行常规培养,其中含10%的胎牛血清(FBS, Gibco),1%的100 U·mL-1青霉素和100 U·mL-1链霉素(中国碧云天生物技术公司)。细胞以每孔10 000个的密度铺至96孔板中,之后加入不同浓度的3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料(浓度分别为0、1、10、50和100 μg mL-1)置于37 ℃、5% CO2和95%空气的加湿培养箱中培养24 h。
1.3 细胞活力检测
3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料对RAW264.7细胞活力的影响采用购自美仑生物技术有限公司(大连,中国)的CCK-8试剂盒进行评估。细胞以每孔8 000个的密度铺至96孔板中,之后加入3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料。暴露结束后,每孔加入10 μL的CCK-8试剂继续孵育4 h,采用酶标仪(美国SpectraMax Ms公司,Molecular Devices)在450 nm波长下测定吸光度值,用630 nm波长下的吸光度值扣除背景。
1.4 蛋白组测序及生物信息学分析
3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料对RAW264.7细胞暴露处理24 h后,用PBS洗3次以充分去除颗粒物和培养液,使用购买于碧云天生物技术公司的试剂提取总蛋白。取蛋白样品100 μg进行酶解烷基化以及标记,之后用反相C18柱进行高pH液相分离。采用Tandem Mass Tags(TMT)技术对蛋白质进行定量,定量结果采用Proteome Discoverer TM Software 2.2进行分析。使用R语言中的t. test函数计算样本间差异显著性P值,同时计算组间差异倍数(fold change, FC),显著差异表达蛋白的筛选标准如下:P<0.05且FC>1.2为上调蛋白,P<0.05且FC<0.83为下调蛋白。选择GO(http://geneontology.org/)对所有的差异蛋白进行功能聚类分析,采用KEGG(http://www.genome.jp/kegg//)通路数据库对差异蛋白质涉及的代谢通路进行分析。采用美吉生物云平台(www.majorbio.com)对蛋白质组学测序的数据进行分析。通过PCA(Principal Component Analysis)分析发现同组的3个样本距离很近,表明样本间的相似性较高(图S2)。3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料暴露组在PC2的方向与对照组样本分离,75 nm聚苯乙烯纳塑料暴露组在PC1的方向与PS-MP暴露分离,表明3组样本之间存在非常有效的区别。
1.5 统计分析
本研究所有实验进行3次重复,以独立实验的平均值+SD表示。组间的统计学差异采用单因素方差分析(ANOVA)进行统计分析。*代表P<0.05被认为具有统计学意义,使用GraphPad prism 9.0软件进行统计分析。
2 结果(Results)
2.1 微/纳塑料的形貌特征
采用TEM表征发现3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料均呈圆球形状,在溶液中没有明显的聚集现象。3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料的平均粒径分别是(3.0±0.5) μm和(74.28±0.26) nm。FTIR分析表明2种聚苯乙烯微/纳塑料的特征峰出现在相同的位置。TEM、马尔文激光粒度仪和FTIR的表征结果表明本研究所使用的微塑料和纳塑料只有粒径不同,材料的形貌和组成成分均相同。
2.2 微/纳塑料对RAW264.7细胞的细胞毒性
通过CCK-8法测定3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料对RAW264.7细胞的细胞毒性效应。如图2所示,CCK-8的检测结果表明2种微/纳塑料均以剂量依赖的方式导致RAW264.7的细胞活力下降,其最低有效浓度为1 μg·mL-1。通过比较相同浓度(10、50和100 μg·mL-1)微/纳塑料对细胞活力和活细胞百分比的影响,发现75 nm聚苯乙烯纳塑料比3 μm聚苯乙烯微塑料表现出更强的细胞毒性(图1)。基于以上结果,发现3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料对RAW264.7细胞都具有细胞毒性,且75 nm聚苯乙烯纳塑料的细胞毒性作用强于3 μm聚苯乙烯微塑料。
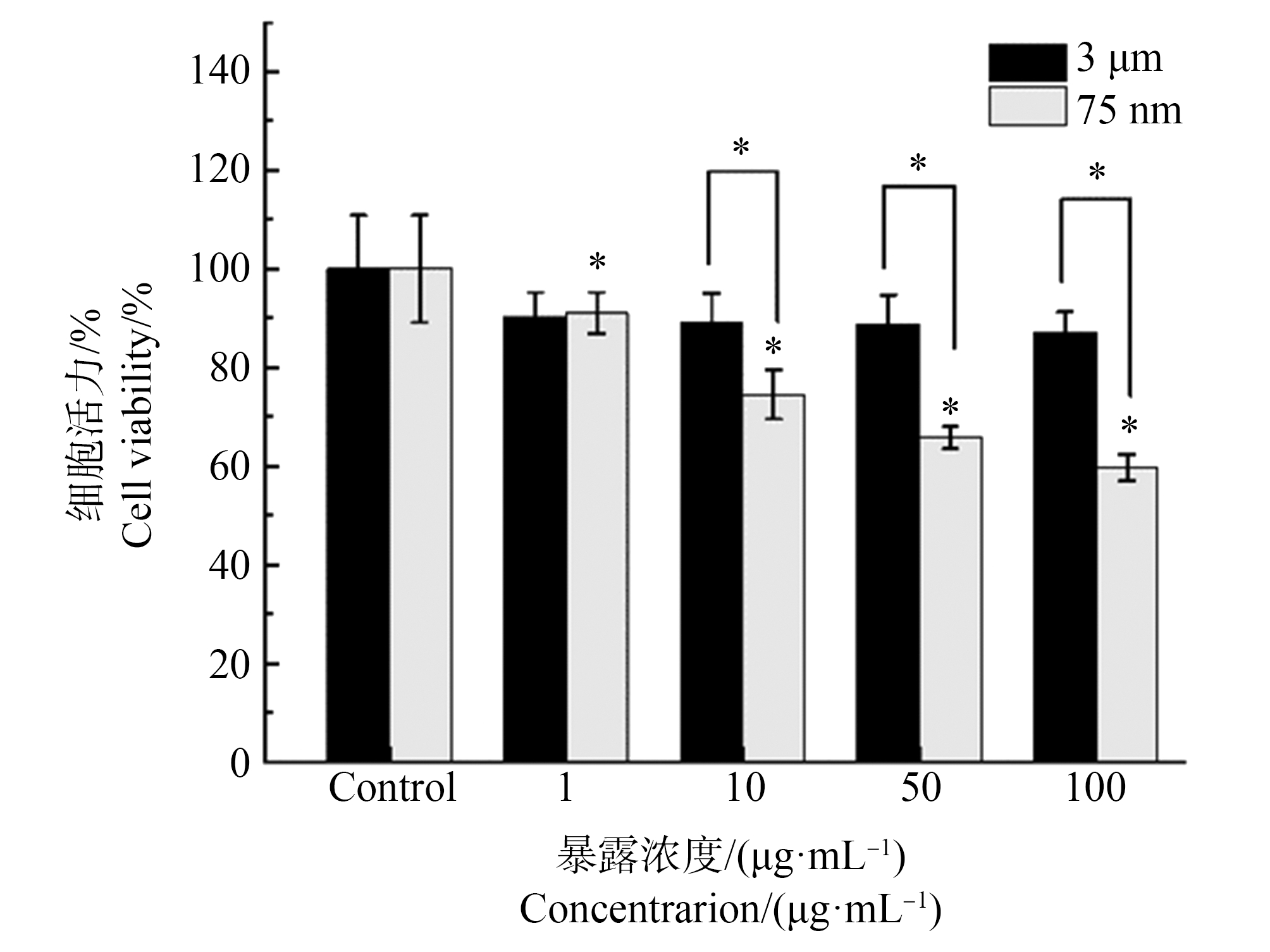
图1 采用CCK-8法检测3 μm聚苯乙烯微塑料(PS-MP)和75 nm聚苯乙烯纳塑料(PS-NP)对RAW264.7细胞的细胞毒性
注:该结果为3组独立实验的均值+SD;*代表对应组与对照组相比P<0.05。
Fig. 1 Cytotoxic effects of 3 μm polystyrene microplastics (PS-MP) and 75 nm polystyrene nanoplastics (PS-MP) in RAW264.7 cells
Note: The results shown here are obtained from three independent experiments and are presented as the means±SD; *P<0.05 compared with the control group.
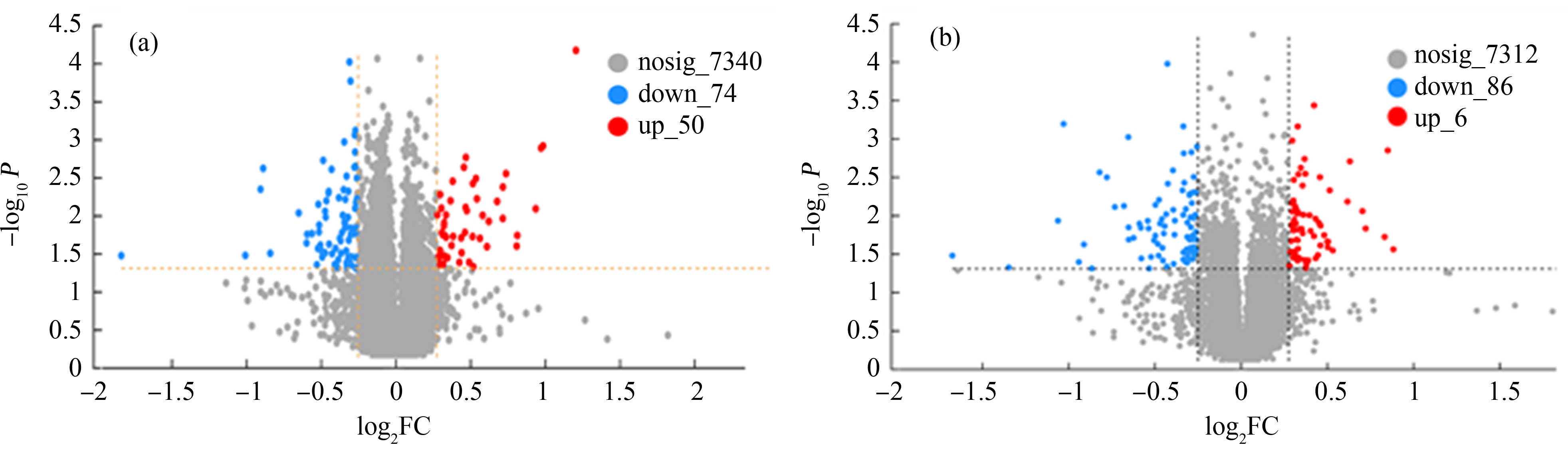
图2 RAW264.7细胞中显著差异表达蛋白(DEPs)的火山图
注:(a)3 μm聚苯乙烯微塑料诱导差异表达蛋白质的数量;(b)75 nm聚苯乙烯纳塑料诱导差异表达蛋白质的数量。
Fig. 2 Volcano plots of significantly differentially expressed proteins (DEPs) in RAW264.7 cells
Note: (a) Number of DEPs induced by 3 μm polystyrene microplastics; (b) Number of DEPs induced by 75 nm polystyrene nanoplastics.
2.3 蛋白质组学研究微/纳塑料对RAW264.7细胞蛋白质表达的影响
为了探究3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料对RAW264.7细胞生物学功能的影响,首先采用蛋白质组学分析了2种尺寸的微/纳塑料对巨噬细胞蛋白质表达的影响。如图2(a)所示,与对照组相比,3 μm聚苯乙烯微塑料下调和上调的蛋白质数量分别为74和50。如图2(b)所示,与对照组相比,75 nm聚苯乙烯纳塑料下调和上调的蛋白质数量分别为86和66。以上结果表明75 nm聚苯乙烯纳塑料诱导RAW264.7细胞蛋白质发生差异表达的数量较3 μm聚苯乙烯微塑料多。
因此,通过Venn分析鉴定了3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料分别上调和下调蛋白集中蛋白质的重叠关系。如图3(a)所示,3 μm聚苯乙烯微塑料下调的特有蛋白质有31个,75 nm聚苯乙烯纳塑料下调的特有蛋白质有43个,3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料下调的共有蛋白质43个。由图3(b)可知,3 μm聚苯乙烯微塑料上调的特有蛋白质有30个,75 nm聚苯乙烯纳塑料上调的特有蛋白质有46个,3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料上调的共有蛋白质有20个。
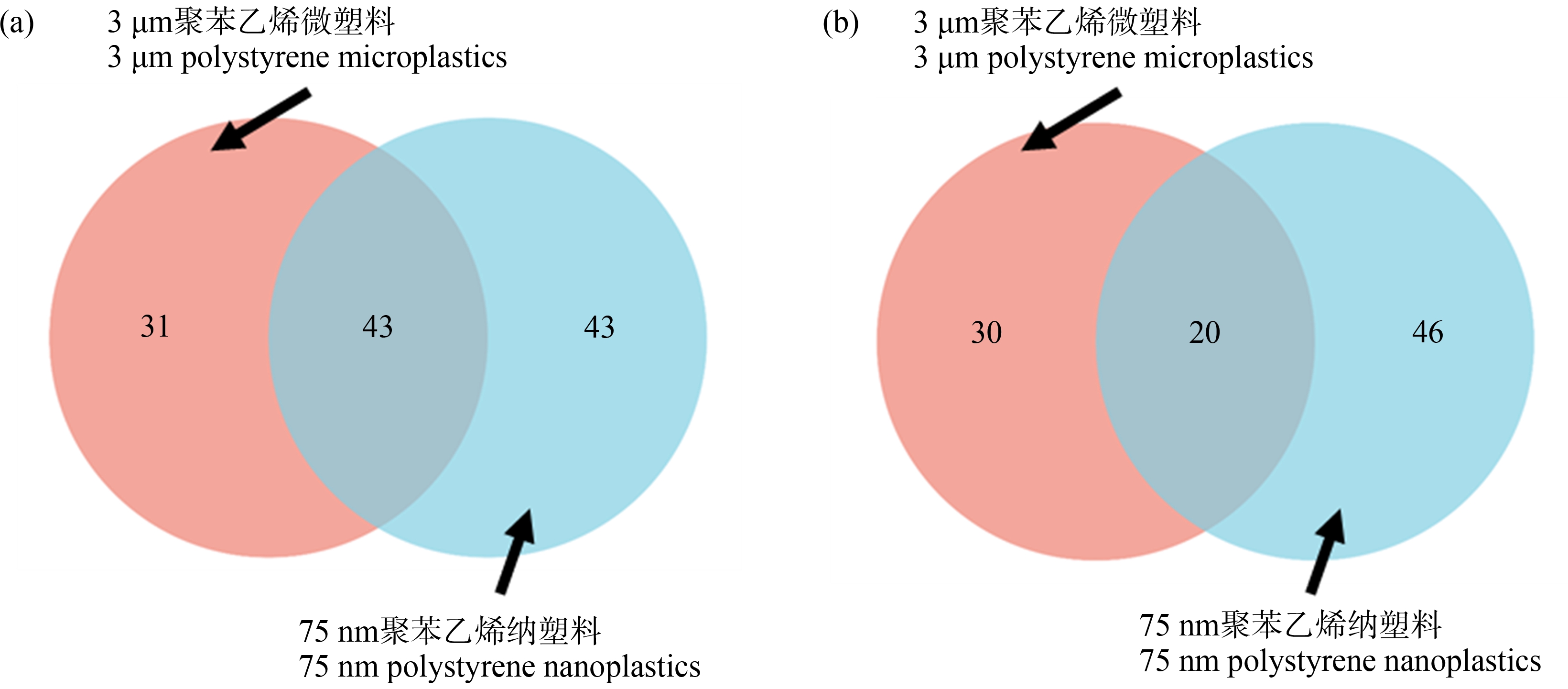
图3 RAW264.7细胞中显著差异表达蛋白质的Venn分析
注:(a)3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料下调的差异表达蛋白集中共有和特有的蛋白质;(b)3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料上调的差异表达蛋白集中共有和特有的蛋白质。
Fig. 3 Venn diagram of DEPs in RAW264.7 cells
Note: (a) 3 μm polystyrene microplastics and 75 nm polystyrene nanoplastics down-regulated the common and unique proteins in the DEPs; (b) 3 μm polystyrene microplastics and 75 nm polystyrene nanoplastics up-regulated the common and unique proteins in the DEPs.
2.4 差异表达蛋白的GO功能注释分类及富集分析
进一步对差异表达蛋白集中的蛋白质进行了GO功能注释分析并进行分类统计,探究3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料对RAW264.7细胞生物学功能的潜在影响。GO功能注释分析发现,3 μm聚苯乙烯微塑料诱导的差异表达蛋白质在参与生物学过程、细胞组分以及分子功能的条目数分别是23、4和12个。75 nm聚苯乙烯纳塑料诱导的差异表达蛋白质在参与这三大生物学功能的条目数分别是35、4和15个。还进一步对GO功能注释进行了富集分析,筛选出了微塑料和纳塑料诱导差异表达蛋白质参与的最显著的前20个生物学功能。如图4(a)所示,3 μm聚苯乙烯微塑料导致三大生物学功能变化最显著的前20个条目包括:7个生物学过程、10个细胞组分和3个分子功能。75 nm聚苯乙烯纳塑料导致三大生物学功能变化最显著的前20个条目包括:8个生物学过程、5个细胞组分以及7个分子功能(图4(b))。以上这些结果表明3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料对RAW264.7细胞的三大生物学功能都有影响。
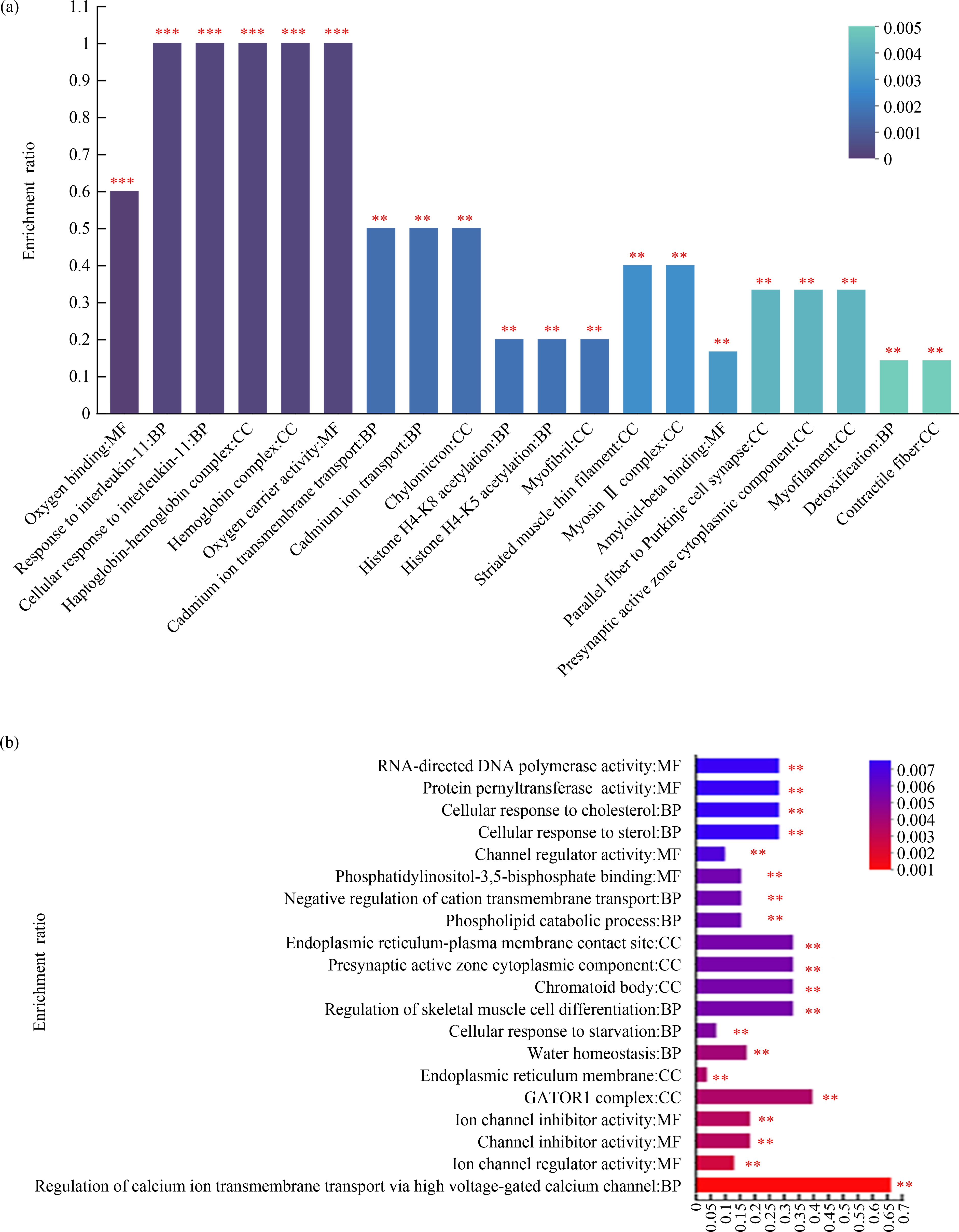
图4 3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料暴露24 h后,RAW264.7细胞中差异表达蛋白质的GO功能显著性富集分析
注:(a) 3 μm聚苯乙烯微塑料诱导差异表达蛋白质的GO功能富集条目;(b) 75 nm聚苯乙烯纳塑料诱导差异表达蛋白质的GO功能富集条目。
Fig. 4 Analysis of DEPs significantly enriched on GO terms in RAW264.7 cells, after treated with 3 μm polystyrene microplastics and 75 nm polystyrene nanoplastics for 24 h
Note: (a) 3 μm polystyrene microplastics-induced DEPs significantly enriched GO terms; (b) 75 nm polystyrene nanoplastics-induced DEPs significantly enriched GO terms.
2.5 差异表达蛋白的KEGG通路功能注释分类及富集分析
在本研究中,还对差异蛋白集进行KEGG通路功能注释的分类统计。差异表达蛋白质注释到的通路与新陈代谢、遗传信息处理、环境信息处理、细胞过程、有机系统和人类疾病等相关。其中注释到与新陈代谢、有机系统和人类疾病相关的通路的数量最多。进一步对差异表达蛋白所注释到的通路进行了富集分析,筛选出了3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料诱导变化最显著的前20条信号通路。如图5(a)所示,3 μm聚苯乙烯微塑料对MAPK、慢性粒白血病和新陈代谢等信号通路上的蛋白质表达的影响最显著。75 nm聚苯乙烯纳塑料诱导的差异表达蛋白质主要参与细胞周期、炎症性肠病、细胞因子及其受体的相互作用和自噬等信号通路(图5(b))。以上这些结果表明3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料都对RAW264.7细胞中调节生物功能的信号通路有显著影响。

图5 3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料暴露24 h后,RAW264.7细胞中差异表达蛋白质的KEGG通路功能显著性富集分析
注:(a) 3 μm聚苯乙烯微塑料诱导的差异表达蛋白质富集的通路;(b) 75 nm聚苯乙烯纳塑料诱导的的差异表达蛋白质富集的通路;
图中横轴为富集率,纵轴为通路名称,圆圈颜色代表对应通路富集P值的大小,圈圈大小代表该通路中差异蛋白数量。
Fig. 5 Analysis of DEPs significantly enriched on KEGG pathways in RAW264.7 cells, after treated with 3 μm polystyrene microplastics and 75 nm polystyrene nanoplastics for 24 h
Note: (a) 3 μm polystyrene microplastics-induced DEPs significantly enriched KEGG pathways; (b) 75 nm polystyrene nanoplastics-induced DEPs significantly enriched KEGG pathways; in the figures, the horizontal axis is the rich factor, the vertical axis is the pathway name, the circle color represents the magnitude of the enrichment P-value of the corresponding pathway, and the circle size represents the number of differential proteins in the pathway.
3 讨论(Discussion)
在本工作中,基于蛋白质组学方法研究了微/纳塑料暴露对RAW264.7细胞生物学功能的潜在影响。通过研究微/纳塑料暴露对细胞蛋白质表达的影响,发现3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料都会引起RAW264.7细胞的蛋白质表达发生变化,且75 nm聚苯乙烯纳塑料诱导差异表达蛋白质的数量较3 μm聚苯乙烯微塑料多。这个结果表明尺寸较小的纳塑料较微塑料的毒性效应更强。
一方面,可能是由于尺寸较小的颗粒拥有更大的比表面积,导致其具有更大的生物有效性从而会诱导更大的毒性作用[28]。另一方面,也可能是由于细胞对较小尺寸粒子的摄入能力更强以及摄入量更高[29]。通过对这些差异表达的蛋白质进行了GO功能注释分析,发现微/纳塑料对细胞三大生物学功能的影响程度是:生物学过程>分子功能>细胞组分。进一步通过GO富集分析,发现PS-M/NP诱导差异表达的蛋白质主要参与细胞因子及其受体的相互作用以及载氧活性等生物学过程。细胞因子及其受体的相互作用被干扰可能会导致细胞因子的异常分泌,细胞因子是免疫细胞调节自身免疫反应中的关键调节剂,免疫失调会诱导慢性炎症的发生和发展,进而可能会导致炎症性疾病[28-30]。载氧活性发生改变可能会导致细胞内活性氧水平过度升高从而打破抗氧化系统的平衡,这会诱导巨噬细胞发生氧化应激[31]。氧化应激可能会诱导巨噬细胞发生凋亡,大量的细胞死亡往往伴随着机体组织损伤,组织的局部损伤有导致炎症的风险。同时,巨噬细胞内活性氧水平的过度升高可能会导致慢性炎症的发生进而导致炎症性疾病。这部分研究结果提示微/纳塑料可能会影响巨噬细胞炎症反应相关的生物功能。另外,通过对差异表达蛋白质进行KEGG富集分析,发现3 μm聚苯乙烯微塑料和75 nm聚苯乙烯纳塑料暴露与炎症性肠病、MAPK以及免疫相关疾病的信号通路有关。MAPK通路有三级的信号传递过程:MAPK,MAPK激酶(MEK或MKK)以及MAPK激酶的激酶(MEKK或MKKK)。这3种激酶能依次激活,共同调节着细胞的生长、分化、应激、炎症反应等多种重要的生理/病理效应。MAPK通路既参与调控细胞内活性氧的水平也参与调控炎症反应,活性氧、炎症与免疫之间有着密不可分的联系[30, 32-35]。因此,MAPK通路的正常激活被干扰,巨噬细胞自身的生长分化都会受到影响甚至可能会导致巨噬细胞对活性氧的应激反应以及对炎症的调控作用失常。KEGG富集分析的结果同样表明微/纳塑料可能会影响巨噬细胞炎症反应相关的生物功能。综合GO富集分析和KEGG富集分析的结果,发现微/纳塑料可能会对巨噬细胞的多个生物学功能产生影响,其中最需要受到关注的是炎症反应相关的功能。微/纳塑料可能通过干扰巨噬细胞中炎症信号通路的激活促进炎症相关的疾病的发展,也可能会通过干扰巨噬细胞自身功能的异常发挥干扰其在免疫反应中的调节作用,最终可能会通过连锁反应损害其在机体中的免疫调节功能。微/纳塑料对巨噬细胞的毒理学机制可能是复杂的,不同尺寸的颗粒,其毒理学机制也可能存在差异。因此,未来需要对这些机制以及不同尺度颗粒诱导毒性的作用机制之间的差异进行系统的研究。这项研究可为微/纳塑料暴露对人体免疫细胞的风险评估提供科学依据,对明确摄入微/纳塑料的潜在危害具有比较重要的意义。
通信作者简介:任肖敏(1986—),女,博士,教授,主要研究方向为新污染物对人体健康潜在的影响。
共同通信作者简介:潘学军(1970—),男,博士,教授,主要研究方向为新污染物的化学行为和生态毒理学。
[1] Suaria G, Avio C G, Mineo A, et al. The Mediterranean Plastic Soup: Synthetic polymers in Mediterranean surface waters [J]. Scientific Reports, 2016, 6: 37551
[2] Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304(5672): 838
[3] Auta H S, Emenike C U, Fauziah S H. Distribution and importance of microplastics in the marine environment: A review of the sources, fate, effects, and potential solutions [J]. Environment International, 2017, 102: 165-176
[4] Lambert S, Wagner M. Characterisation of nanoplastics during the degradation of polystyrene [J]. Chemosphere, 2016, 145: 265-268
[5] Alimi O S, Farner Budarz J, Hernandez L M, et al. Microplastics and nanoplastics in aquatic environments: Aggregation, deposition, and enhanced contaminant transport [J]. Environmental Science &Technology, 2018, 52(4): 1704-1724
[6] Zhang K, Shi H H, Peng J P, et al. Microplastic pollution in China’s inland water systems: A review of findings, methods, characteristics, effects, and management [J]. Science of the Total Environment, 2018, 630: 1641-1653
[7] Zhang G S, Liu Y F. The distribution of microplastics in soil aggregate fractions in southwestern China [J]. Science of the Total Environment, 2018, 642: 12-20
[8] Chu J H, Liu H M, Salvo A. Air pollution as a determinant of food delivery and related plastic waste [J]. Nature Human Behaviour, 2021, 5(2): 212-220
[9] Rahman A, Sarkar A, Yadav O P, et al. Potential human health risks due to environmental exposure to nano- and microplastics and knowledge gaps: A scoping review [J]. Science of the Total Environment, 2021, 757: 143872
[10] Zhang Q, Xu E G, Li J N, et al. A review of microplastics in table salt, drinking water, and air: Direct human exposure [J]. Environmental Science &Technology, 2020, 54(7): 3740-3751
[11] Ranjan V P, Joseph A, Goel S. Microplastics and other harmful substances released from disposable paper cups into hot water [J]. Journal of Hazardous Materials, 2021, 404: 124118
[12] Zuccarello P, Ferrante M, Cristaldi A, et al. Exposure to microplastics (<10 μm) associated to plastic bottles mineral water consumption: The first quantitative study [J]. Water Research, 2019, 157: 365-371
[13] Fadare O O, Wan B, Guo L H, et al. Microplastics from consumer plastic food containers: Are we consuming it? [J]. Chemosphere, 2020, 253: 126787
[14] Yang D Q, Shi H H, Li L, et al. Microplastic pollution in table salts from China [J]. Environmental Science &Technology, 2015, 49(22): 13622-13627
[15] Liebezeit G, Liebezeit E. Non-pollen particulates in honey and sugar [J]. Food Additives &Contaminants Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2013, 30(12): 2136-2140
[16] Catarino A I, Macchia V, Sanderson W G, et al. Low levels of microplastics (MP) in wild mussels indicate that MP ingestion by humans is minimal compared to exposure via household fibres fallout during a meal [J]. Environmental Pollution, 2018, 237: 675-684
[17] Schwabl P, Köppel S, Königshofer P, et al. Detection of various microplastics in human stool: A prospective case series [J]. Annals of Internal Medicine, 2019, 171(7): 453-457
[18] Yan Z H, Liu Y F, Zhang T, et al. Analysis of microplastics in human feces reveals a correlation between fecal microplastics and inflammatory bowel disease status [J]. Environmental Science &Technology, 2022, 56(1): 414-421
[19] Peterson L W, Artis D. Intestinal epithelial cells: Regulators of barrier function and immune homeostasis [J]. Nature Reviews Immunology, 2014, 14(3): 141-153
[20] Gerbe F, Legraverend C, Jay P. The intestinal epithelium tuft cells: Specification and function [J]. Cellular and Molecular Life Sciences, 2012, 69(17): 2907-2917
[21] Ulluwishewa D, Anderson R C, McNabb W C, et al. Regulation of tight junction permeability by intestinal bacteria and dietary components [J]. The Journal of Nutrition, 2011, 141(5): 769-776
[22] Zhang S Z, Zhao X H, Zhang D C. Retraction Note: Cellular and molecular immunopathogenesis of ulcerative colitis [J]. Cellular &Molecular Immunology, 2014, 11(3): 314
[23] Cao X Q, Han Y H, Gu M, et al. Foodborne titanium dioxide nanoparticles induce stronger adverse effects in obese mice than non-obese mice: Gut microbiota dysbiosis, colonic inflammation, and proteome alterations [J]. Small, 2020, 16(36): e2001858
[24] Moon K S, Bae J M, Oh S. The diameter effect of TiO2 nanotube on inflammatory response in Raw 264.7 macrophages [J]. Korean Journal of Dental Materials, 2013, 40(1): 25-32
[25] Tsugita M, Morimoto N, Nakayama M. SiO2 and TiO2 nanoparticles synergistically trigger macrophage inflammatory responses [J]. Particle and Fibre Toxicology, 2017, 14(1): 11
[26] Gu W Q, Liu S, Chen L, et al. Single-cell RNA sequencing reveals size-dependent effects of polystyrene microplastics on immune and secretory cell populations from zebrafish intestines [J]. Environmental Science &Technology, 2020, 54(6): 3417-3427
[27] Hwang J, Choi D, Han S, et al. An assessment of the toxicity of polypropylene microplastics in human derived cells [J]. The Science of the Total Environment, 2019, 684: 657-669
[28] Yee M S L, Hii L W, Looi C K, et al. Impact of microplastics and nanoplastics on human health [J]. Nanomaterials, 2021, 11(2): 496
[29] Varela J A, Bexiga M G, Åberg C, et al. Quantifying size-dependent interactions between fluorescently labeled polystyrene nanoparticles and mammalian cells [J]. Journal of Nanobiotechnology, 2012, 10: 39
[30] Verreck F A W, de Boer T, Langenberg D M L, et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria [J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(13): 4560-4565
[31] Fillatreau S, Sweenie C H, McGeachy M J, et al. B cells regulate autoimmunity by provision of IL-10 [J]. Nature Immunology, 2002, 3(10): 944-950
[32] Grivennikov S I, Greten F R, Karin M. Immunity, inflammation, and cancer [J]. Cell, 2010, 140(6): 883-899
[33] Dörpinghaus M, Brieger A, Panichkina O, et al. Lead ions abrogate lipopolysaccharide-induced nitric monoxide toxicity by reducing the expression of STAT1 and iNOS [J]. Journal of Trace Elements in Medicine and Biology, 2016, 37: 117-124
[34] Zhou M X, Xu W M, Wang J Z, et al. Boosting mTOR-dependent autophagy via upstream TLR4-MyD88-MAPK signalling and downstream NF-κB pathway quenches intestinal inflammation and oxidative stress injury [J]. EBioMedicine, 2018, 35: 345-360
[35] Xia T, Korge P, Weiss J N, et al. Quinones and aromatic chemical compounds in particulate matter induce mitochondrial dysfunction: Implications for ultrafine particle toxicity [J]. Environmental Health Perspectives, 2004, 112(14): 1347-1358
[36] Foster K A, Galeffi F, Gerich F J, et al. Optical and pharmacological tools to investigate the role of mitochondria during oxidative stress and neurodegeneration [J]. Progress in Neurobiology, 2006, 79(3): 136-171
[37] Bai Y J, Jiang Y Y, Liu T W, et al. Xinjiang herbal tea exerts immunomodulatory activity via TLR2/4-mediated MAPK signaling pathways in RAW264.7 cells and prevents cyclophosphamide-induced immunosuppression in mice [J]. Journal of Ethnopharmacology, 2019, 228: 179-187