水生植物恢复是目前水体富营养化控制的主要生物措施之一,越来越多种类的水生植物被用于富营养化水体的生态修复[1]。菖蒲(Acorus calamus L.),天南星科挺水植物,能有效吸收污染水体中的氮和磷[2],是富营养化水体植物修复的重要物种。然而,富营养化水体中发生水华频率较高的微囊藻通常是产毒藻[3],其在生长期间和死亡后会向水体中释放微囊藻毒素(microcystins, MCs)。MCs是产毒微囊藻的次生代谢产物,已鉴定出100多种变体[4],其中LR型(MC-LR)是毒性最强和最常见的变型[5]。目前,已报道的自然水体中MC-LR的浓度一般低于0.03 mg·L-1[6-7]。
大量研究表明,环境相关浓度MCs暴露会对植物的生长状况产生影响[8-15]。目前研究主要集中于MCs暴露对植物抗氧化系统[8-10]、光合系统[11-13]及生长特性[14-15]影响等方面。刘佳等[8]的研究表明,0.005 mg·L-1 MCs暴露7 d,生菜(Lactuca sativa)体内超氧化物歧化酶(SOD)活性和总抗氧化能力显著上升,生菜鲜质量增加75.31%;陈国元等[13]的研究表明,MC-LR(0.01~0.03 mg·L-1)暴露会降低水雍菜(Ipomoea aquatica)叶片光合酶活性,影响其光合能力;Dong等[9]的研究表明,MC-LR(0.003~0.01 mg·L-1)暴露14 d后,金鱼藻(Ceratophyllum demersum)体内可溶性蛋白、类胡萝卜素及糖类物质含量明显上升,而SOD活性、谷胱甘肽(GSH)含量及鲜质量显著下降。目前,关于环境不同浓度MCs暴露条件下植物的营养吸收特性研究较薄弱。植物营养吸收特性是衡量植物养分吸收能力和生长状况的关键指标,对确定该植物是否适合富营养化水体生态修复具有重要指导意义。营养吸收动力学是研究植物营养吸收特性的常用手段。Claassen和Barber[16]在1974年首先提出了针对完整植株离子吸收动力学的耗竭法,对于比较不同环境条件下植物营养吸收特性的变化提供了有效的方法[17-19]。
氮素是植物生长发育所需的主要营养元素,也是水体富营养化的主要因子之一。自然水体中,![]() 和
和![]() 是植物吸收利用的主要无机氮源。陈国元等[20]研究了MC-LR(0.002~0.01 mg·L-1)暴露条件下梭鱼草(Pontederia cordata Linn.)对单一无机氮源
是植物吸收利用的主要无机氮源。陈国元等[20]研究了MC-LR(0.002~0.01 mg·L-1)暴露条件下梭鱼草(Pontederia cordata Linn.)对单一无机氮源![]() 的吸收动力学特征,但
的吸收动力学特征,但![]() 和
和![]() 在竞争条件下的吸收特性及其机制研究鲜有报道。本研究采用环境中不同浓度MC-LR(0.001~0.03 mg·L-1)暴露条件处理,分析菖蒲根系活力、细胞质膜(PM)H+-ATP酶活性、H2O2和丙二醛(MDA)含量的变化,以及在竞争条件下菖蒲对
在竞争条件下的吸收特性及其机制研究鲜有报道。本研究采用环境中不同浓度MC-LR(0.001~0.03 mg·L-1)暴露条件处理,分析菖蒲根系活力、细胞质膜(PM)H+-ATP酶活性、H2O2和丙二醛(MDA)含量的变化,以及在竞争条件下菖蒲对![]() 和
和![]() 的吸收速率和动力学特征,揭示了环境不同浓度MC-LR暴露条件下菖蒲对
的吸收速率和动力学特征,揭示了环境不同浓度MC-LR暴露条件下菖蒲对![]() 和
和![]() 的吸收特性及其变化规律,为富营养化水体修复中菖蒲的合理利用提供了理论基础。
的吸收特性及其变化规律,为富营养化水体修复中菖蒲的合理利用提供了理论基础。
菖蒲幼苗购至福建省龙海市兴涛花木专业合作社,分别选择株高约15 cm、生长良好的菖蒲幼苗,蒸馏水冲洗干净后再用无菌水清洗,最后将其在1/10 Hoagland’s营养液中培养7 d,选取生长良好的植株用于后续试验。纯MC-LR(瑞士ALEXIS Biochemicals公司),纯度≥96%,购自上海恒远生物科技有限公司。
MC-LR暴露试验:将48株幼苗平均植入12个灭菌的内装400 mL 1/10 Hoagland’s营养液(pH 6.5)的1 000 mL烧杯中,烧杯底层铺有厚度5 cm的石英砂。于光照培养箱(MGC-450BPY-2,上海一恒科学仪器有限公司)中预培养3 d,温度为(25±1) ℃,光照强度为37.5 μmol·m-2·s-1,明暗比为12 h/12 h。然后将培养液替换为内含不同浓度MC-LR(0 mg·L-1为对照组,0.001、0.01和0.03 mg·L-1为处理组)1/10 Hoagland’s营养液,对照组及处理组都设置3个平行。各组每3 d更换一次培养液,每天曝气2 h以防止烂根。培养15 d后,对照组及处理组中分别取3株幼苗(3个平行样本),采集根系样品,测定其干质量、根系活力、PM H+-ATP酶活性、H2O2和MDA含量。
无机氮吸收试验:将每个烧杯中剩余的3株幼苗先用400 mL无氮的1/10 Hoagland’s营养液(不添加Ca(NO3)2·4H2O、KNO3和NH4NO3)培养3 d,然后将培养液更换为加氮改良的1/10 Hoagland’s营养液(具体为:总氮1.5 mmol·L-1,所添加氮源为Ca(NO3)2·4H2O和NH4Cl;为了比较相同条件下![]() 和
和![]() 的吸收情况,
的吸收情况,![]() 和
和![]() 比例设置为1∶1)。在1~46 h内测定营养液中
比例设置为1∶1)。在1~46 h内测定营养液中![]() 和
和![]() 浓度,根据其浓度变化分别计算
浓度,根据其浓度变化分别计算![]() 和
和![]() 的吸收速率。同时根据溶液中
的吸收速率。同时根据溶液中![]() 和
和![]() 的浓度和采样时间,首先求出离子消耗曲线方程Y=a+bx+cx2,然后对该方程求一阶导数得到浓度变化速率方程Y’=b+2cx,据此计算出
的浓度和采样时间,首先求出离子消耗曲线方程Y=a+bx+cx2,然后对该方程求一阶导数得到浓度变化速率方程Y’=b+2cx,据此计算出![]() 和
和![]() 的最大吸收速率(Vmax)和米氏常数(Km)[17]。对照组及处理组均设3个平行。
的最大吸收速率(Vmax)和米氏常数(Km)[17]。对照组及处理组均设3个平行。
在80 ℃下干燥48 h后,测量完整植株和根系的干质量[17]。根系活力采用氯化三苯基四氮唑(TTC)法测定[21]。PM H+-ATP酶活性采用植物H+-ATPase酶联免疫分析试剂盒(上海恒远生物科技有限公司,中国),在SpectraMax M2多功能酶标仪(美国Molecular Devices公司)上测定,检测范围为6~200 IU·L-1。H2O2含量采用二甲酚橙法测定[22]。MDA含量通过硫代巴比妥酸(TBA)法测![]() 和
和![]() 浓度分别采用茚满三酮测定法和对氨基苯磺酸-α-萘胺分光光度法测定[23]。
浓度分别采用茚满三酮测定法和对氨基苯磺酸-α-萘胺分光光度法测定[23]。
运用SPSS 25和Excel 2010软件对数据进行统计分析和作图,并以平均值±标准差(SD)表示。采用方差分析(ANOVA)和最小显著性差异法(LSD)比较不同处理组间根系干质量、根系活力、PM H+-ATP酶活性、H2O2和MDA含量的差异显著性(P<0.05)。采用配对t检验比较不同处理组间无机氮吸收速率的差异显著性(P<0.05)。
由图1可知,0.001 mg·L-1 MC-LR暴露15 d后,菖蒲根系生物量和根系活力比对照组分别增加了15.18%和23.62%,具有显著性差异(P<0.05);0.01 mg·L-1 MC-LR暴露15 d后,菖蒲根系生物量和根系活力比对照组分别增加了12.13%和13.65%,但均未达到显著性水平(P>0.05);0.03 mg·L-1 MC-LR暴露15 d后,菖蒲根系生物量和根系活力比对照组降低了18.13%和21.52%,差异显著(P<0.05)。这表明,0.001 mg·L-1 MC-LR暴露对菖蒲根系活力及根系生长具有显著的促进作用,而0.03 mg·L-1 MC-LR暴露对菖蒲根系活力及根系生长产生了明显的抑制作用。Machado等[15]的也研究表明,0.01 mg·L-1 MC-LR暴露28 d对胡萝卜(Daucus carota)根系生长无显著影响,而0.05 mg·L-1 MC-LR暴露28 d显著抑制了胡萝卜根系的生长。

图1 MC-LR暴露15 d后菖蒲根干质量(a)及根系活力(b)变化
注:MC-LR表示微囊藻毒素-LR;图柱上标不同小写字母表示不同处理间差异显著(P<0.05)。
Fig. 1 The root dry weight (a) and root activity (b) in Acorus calamus L. after 15 d of exposure to MC-LR
Note: MC-LR is the abbreviation of microcystin-leucine-arginine; different letters indicated significant difference between groups (P<0.05).
PM H+-ATP酶是影响植物根系生长和调控营养吸收的关键因子[24]。有研究表明,较低的环境胁迫水平可以增加植物PM H+-ATP酶的活性,而严重的胁迫环境会抑制PM H+-ATP酶的活性,不利于根系生长[25-26]。本研究显示,0.001 mg·L-1 MC-LR暴露条件下,菖蒲根系PM H+-ATP酶活性比对照组增加了33.67%,差异显著(P<0.05);0.01 mg·L-1 MC-LR暴露条件下,菖蒲根系PM H+-ATP酶活性比对照组增加了13.44%,但未达到显著性水平(P>0.05);0.03 mg·L-1 MC-LR暴露条件下,菖蒲根系PM H+-ATP酶活性比对照组降低了22.19%,差异显著(P<0.05)(图2(a))。因此,0.03 mg·L-1 MC-LR暴露导致PM H+-ATP酶活性的显著降低将会对菖蒲根系生长产生不利影响。同时,植物所处的逆境胁迫与其根系生长密切相关。由图2(b)和图2(c)可知,0.01 mg·L-1 MC-LR暴露条件下,菖蒲根系H2O2含量显著增加(P<0.05),而MDA含量与对照组相比无显著性差异(P>0.05),表明0.01 mg·L-1 MC-LR暴露对菖蒲根系产生了轻度胁迫,但没有产生明显的损伤。而0.03 mg·L-1 MC-LR暴露条件下,菖蒲根系H2O2和MDA含量均显著升高(P<0.05),表明菖蒲根系受到了严重的氧化胁迫,从而对其生长及生理生化活性产生显著影响。
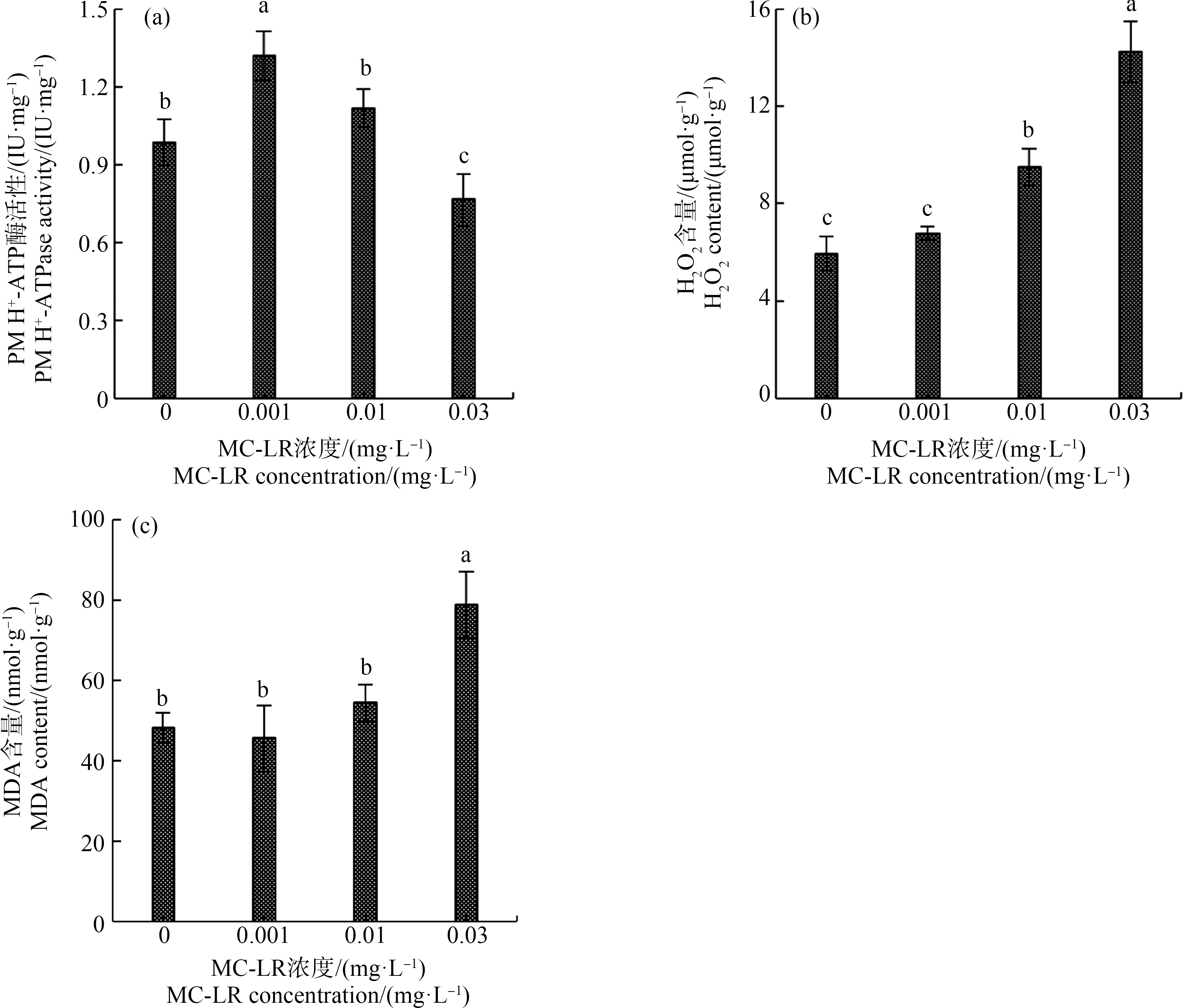
图2 MC-LR暴露15 d后菖蒲根系PM H+-ATP酶活性(a)、H2O2(b)及MDA含量(c)变化
注:PM、MDA和MC-LR分别表示细胞质膜、丙二醛和微囊藻毒素-LR;图柱上标不同小写字母表示不同处理间差异显著(P<0.05)。
Fig. 2 The PM H+-ATPase activity (a), H2O2 (b) and MDA content (c) in root of Acorus calamus L. after 15 d of exposure to MC-LR
Note: PM, MDA and MC-LR are the abbreviations of plasma membrane, malondialdehyde and microcystin-leucine-arginine, respectively; different letters indicated significant difference between groups (P<0.05).
由图3可知,0.001 mg·L-1 MC-LR暴露15 d后,菖蒲对总无机氮的吸收速率在前4 h显著高于对照组(P<0.05),对![]() 的吸收速率在前7 h显著高于对照组(P<0.05),对
的吸收速率在前7 h显著高于对照组(P<0.05),对![]() 的吸收速率在前13 h显著高于对照组(P<0.05)。0.01 mg·L-1 MC-LR暴露15 d后,菖蒲对总无机氮的吸收速率与对照组差异不显著(P>0.05),对
的吸收速率在前13 h显著高于对照组(P<0.05)。0.01 mg·L-1 MC-LR暴露15 d后,菖蒲对总无机氮的吸收速率与对照组差异不显著(P>0.05),对![]() 的吸收速率在前7 h显著高于对照组(P<0.05),而对
的吸收速率在前7 h显著高于对照组(P<0.05),而对![]() 的吸收速率在前13 h显著低于对照组(P<0.05)。0.03 mg·L-1 MC-LR暴露15 d后,菖蒲对
的吸收速率在前13 h显著低于对照组(P<0.05)。0.03 mg·L-1 MC-LR暴露15 d后,菖蒲对![]() 和
和![]() 的吸收速率较对照组均显著降低(P<0.05)。这表明,0.001 mg·L-1 MC-LR暴露对菖蒲的
的吸收速率较对照组均显著降低(P<0.05)。这表明,0.001 mg·L-1 MC-LR暴露对菖蒲的![]() 和
和![]() 吸收均有促进作用;0.01 mg·L-1 MC-LR暴露对菖蒲的
吸收均有促进作用;0.01 mg·L-1 MC-LR暴露对菖蒲的![]() 吸收有促进作用,对
吸收有促进作用,对![]() 的吸收表现出抑制作用,但是总无机氮吸收速率没有发生明显变化。0.03 mg·L-1 MC-LR暴露对菖蒲的
的吸收表现出抑制作用,但是总无机氮吸收速率没有发生明显变化。0.03 mg·L-1 MC-LR暴露对菖蒲的![]() 和
和![]() 吸收均表现出抑制作用,从而导致其总无机氮吸收速率显著降低。
吸收均表现出抑制作用,从而导致其总无机氮吸收速率显著降低。

图3 MC-LR暴露15 d后菖蒲的总无机氮![]() 及
及![]() 吸收速率(c)的变化
吸收速率(c)的变化
注:MC-LR表示微囊藻毒素-LR。
Fig. 3 The uptake rate of total inorganic nitrogen (a), ![]() (b) and
(b) and ![]() (c) in Acorus calamus L. after 15 d of exposure to MC-LR
(c) in Acorus calamus L. after 15 d of exposure to MC-LR
Note: MC-LR is the abbreviation of microcystin-leucine-arginine.
植物对营养物质的吸收与其根系发育状态密切相关[27]。有研究表明,氮磷吸收能力强的水生植物根系活力高[27]。因此,0.03 mg·L-1 MC-LR暴露条件下,菖蒲根系生物量和根系活力的显著下降抑制了其对氮素的吸收。另外,根系PM H+-ATP酶不仅可以通过H+跨膜转运的主动运输参与![]() 吸收,也可通过H+的被动转运和交换来促进
吸收,也可通过H+的被动转运和交换来促进![]() 吸收[28]。有研究表明,严重的胁迫环境会抑制PM H+-ATP酶的活性,从而导致植物
吸收[28]。有研究表明,严重的胁迫环境会抑制PM H+-ATP酶的活性,从而导致植物![]() 通量和体内氮含量降低[25-26]。因此,0.03 mg·L-1 MC-LR暴露条件下,菖蒲PM H+-ATP酶活性的显著降低抑制了菖蒲对无机氮的吸收。同时,植物的生理状况直接影响其对营养物质的吸收[29]。大量研究表明,MC-LR对植物生理特性的影响具有剂量依赖性[9-13, 29]。0.001 mg·L-1 MC-LR暴露对菖蒲氮吸收的影响可能是一种类似于激素作用的“低剂量效应”[29],其可以显著提升植物体内某些关键酶的活性,加强植物根、茎、叶的生理生化活动[11-15, 29],从而增加植物对氮的吸收。而0.03 mg·L-1 MC-LR暴露条件下,菖蒲根系受到了严重的氧化胁迫,从而对其生理生化活性产生显著影响。有研究表明,0.03 mg·L-1 MC-LR暴露会显著抑制植物体内参与氮循环的相关酶类的活性[29],并对光合和光呼吸作用等生理生化过程产生不利影响[11],进而降低其对无机氮的吸收。
通量和体内氮含量降低[25-26]。因此,0.03 mg·L-1 MC-LR暴露条件下,菖蒲PM H+-ATP酶活性的显著降低抑制了菖蒲对无机氮的吸收。同时,植物的生理状况直接影响其对营养物质的吸收[29]。大量研究表明,MC-LR对植物生理特性的影响具有剂量依赖性[9-13, 29]。0.001 mg·L-1 MC-LR暴露对菖蒲氮吸收的影响可能是一种类似于激素作用的“低剂量效应”[29],其可以显著提升植物体内某些关键酶的活性,加强植物根、茎、叶的生理生化活动[11-15, 29],从而增加植物对氮的吸收。而0.03 mg·L-1 MC-LR暴露条件下,菖蒲根系受到了严重的氧化胁迫,从而对其生理生化活性产生显著影响。有研究表明,0.03 mg·L-1 MC-LR暴露会显著抑制植物体内参与氮循环的相关酶类的活性[29],并对光合和光呼吸作用等生理生化过程产生不利影响[11],进而降低其对无机氮的吸收。
对照组和MC-LR暴露条件下,菖蒲的![]() 吸收速率均显著高于
吸收速率均显著高于![]() 吸收速率(P<0.05),表明菖蒲对
吸收速率(P<0.05),表明菖蒲对![]() 的吸收优于对
的吸收优于对![]() 的吸收。0.01 mg·L-1 MC-LR暴露条件下,菖蒲对
的吸收。0.01 mg·L-1 MC-LR暴露条件下,菖蒲对![]() 的吸收速率增加,而对
的吸收速率增加,而对![]() 的吸收速率降低,说明MC-LR暴露条件下菖蒲对
的吸收速率降低,说明MC-LR暴露条件下菖蒲对![]() 和
和![]() 的吸收存在不同的响应机制。
的吸收存在不同的响应机制。![]() 吸收的相对增加可能是菖蒲对MC-LR胁迫的一种适应性反应。这主要是因为
吸收的相对增加可能是菖蒲对MC-LR胁迫的一种适应性反应。这主要是因为![]() 的吸收和同化需要较多的能量,而
的吸收和同化需要较多的能量,而![]() 是植物容易吸收的氮源。此外,
是植物容易吸收的氮源。此外,![]() 可以促进植物根系的生长[30],增强植物对不利环境条件的抵抗力[31]。Zhang[32]研究发现,在盐胁迫条件下,小叶杨(Populus simonii)对
可以促进植物根系的生长[30],增强植物对不利环境条件的抵抗力[31]。Zhang[32]研究发现,在盐胁迫条件下,小叶杨(Populus simonii)对![]() 的吸收增加,而对
的吸收增加,而对![]() 的吸收减少。因此,在MC-LR胁迫条件下,菖蒲通过减少对
的吸收减少。因此,在MC-LR胁迫条件下,菖蒲通过减少对![]() 的吸收,增加对
的吸收,增加对![]() 的吸收来补偿其对无机氮的需求,促进植物根系的生长,增强其抗逆性。
的吸收来补偿其对无机氮的需求,促进植物根系的生长,增强其抗逆性。
吸收动力学研究表明,当细胞膜上运输载体的结合位点与溶解态离子结合达到饱和时,离子吸收速率为最大值(Vmax),也被称为吸收潜能[33]。而Km值可以指示运输载体的结合位点与溶解态离子之间的亲和力,较低的Km值表明活性转运位点对吸收离子的亲和力较高,较高的Km值表明活性转运位点对吸收离子的亲和力较低[33]。由表1可知,0.001 mg·L-1 MC-LR暴露后,与对照组相比,菖蒲对![]() 的Vmax值增加了11.25%,Km值增加了33.33%,对
的Vmax值增加了11.25%,Km值增加了33.33%,对![]() 的Vmax值增加了11.86%,Km值降低了12.10%,表明菖蒲对
的Vmax值增加了11.86%,Km值降低了12.10%,表明菖蒲对![]() 和
和![]() 的吸收潜能有所增加,对
的吸收潜能有所增加,对![]() 的亲和力增强,但对
的亲和力增强,但对![]() 的亲和力下降。理论上,较高的Vmax和较低的Km有利于营养物质的高效吸收[33]。Nishikawa等[34]发现,Vmax/Km值较高的植物在营养吸收方面表现出强烈的竞争优势,该值可以衡量植物对
的亲和力下降。理论上,较高的Vmax和较低的Km有利于营养物质的高效吸收[33]。Nishikawa等[34]发现,Vmax/Km值较高的植物在营养吸收方面表现出强烈的竞争优势,该值可以衡量植物对![]() 或
或![]() 的吸收偏好。研究表明,0.001 mg·L-1 MC-LR暴露后,
的吸收偏好。研究表明,0.001 mg·L-1 MC-LR暴露后,![]() 吸收的Vmax/Km值较高,而
吸收的Vmax/Km值较高,而![]() 吸收的Vmax/Km值较低,说明0.001 mg·L-1 MC-LR暴露条件下菖蒲开始优先吸收
吸收的Vmax/Km值较低,说明0.001 mg·L-1 MC-LR暴露条件下菖蒲开始优先吸收![]() mg·L-1 MC-LR暴露后,与对照组相比,菖蒲对
mg·L-1 MC-LR暴露后,与对照组相比,菖蒲对![]() 的Vmax值降低了4.58%,Km值增加了31.40%,对
的Vmax值降低了4.58%,Km值增加了31.40%,对![]() 的Vmax值提高了0.53%,Km值降低了9.27%。0.01 mg·L-1 MC-LR暴露对菖蒲
的Vmax值提高了0.53%,Km值降低了9.27%。0.01 mg·L-1 MC-LR暴露对菖蒲![]() 的吸收有显著影响,降低了菖蒲对
的吸收有显著影响,降低了菖蒲对![]() 的亲和力和吸收潜能。同时,
的亲和力和吸收潜能。同时,![]() 吸收的Vmax/Km值较高,
吸收的Vmax/Km值较高,![]() 吸收的Vmax/Km值较低,说明0.01 mg·L-1 MC-LR暴露条件下菖蒲仍然保持
吸收的Vmax/Km值较低,说明0.01 mg·L-1 MC-LR暴露条件下菖蒲仍然保持![]() 吸收偏好。0.03 mg·L-1 MC-LR暴露条件下,与对照组相比,菖蒲对
吸收偏好。0.03 mg·L-1 MC-LR暴露条件下,与对照组相比,菖蒲对![]() 和
和![]() 的Vmax分别降低了11.93%和6.61%,对
的Vmax分别降低了11.93%和6.61%,对![]() 和
和![]() 的Km值分别增加了1.07倍和35.89%。0.03 mg·L-1 MC-LR暴露对菖蒲的无机氮吸收产生较大影响,不仅降低了菖蒲对
的Km值分别增加了1.07倍和35.89%。0.03 mg·L-1 MC-LR暴露对菖蒲的无机氮吸收产生较大影响,不仅降低了菖蒲对![]() 和
和![]() 的亲和力,也降低了菖蒲对
的亲和力,也降低了菖蒲对![]() 和
和![]() 的吸收潜能,而且与
的吸收潜能,而且与![]() 相比,MC-LR对
相比,MC-LR对![]() 吸收的抑制作用更强。
吸收的抑制作用更强。
表1 MC-LR暴露条件下菖蒲对![]() 和
和![]() 吸收的动力学参数(n=3)
吸收的动力学参数(n=3)
Table 1 Kinetics parameters of ![]() uptake by Acorus calamus L. after exposure to MC-LR (n=3)
uptake by Acorus calamus L. after exposure to MC-LR (n=3)
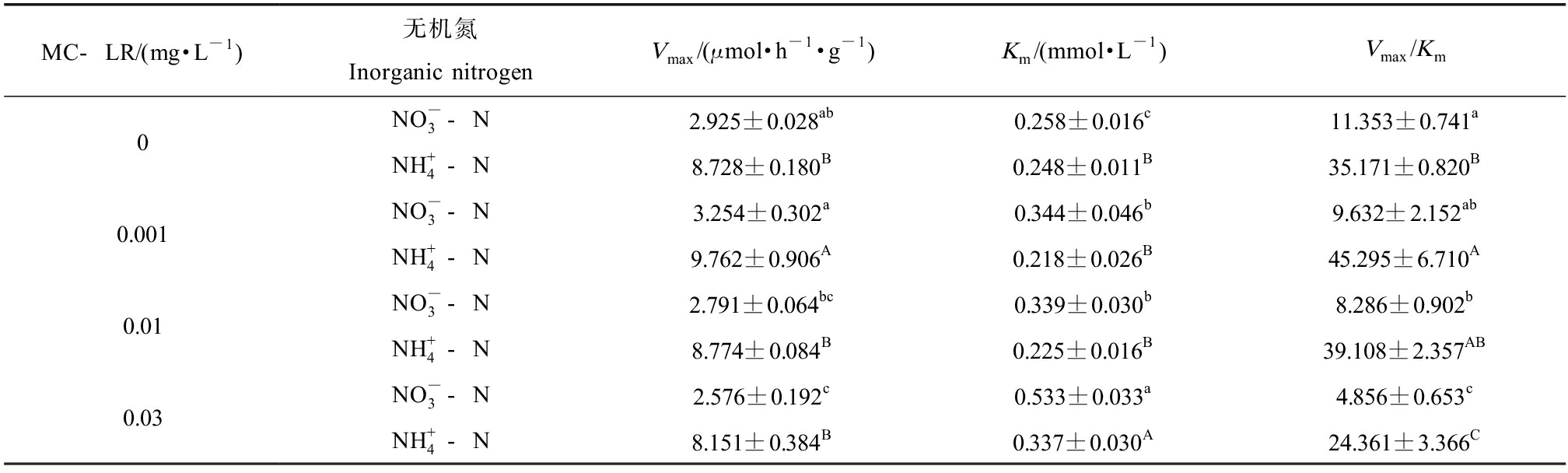
MC-LR/(mg·L-1)无机氮Inorganic nitrogenVmax/(μmol·h-1·g-1)Km/(mmol·L-1)Vmax/Km0NO-3-N2.925±0.028ab0.258±0.016c11.353±0.741aNH+4-N8.728±0.180B0.248±0.011B35.171±0.820B0.001NO-3-N3.254±0.302a0.344±0.046b9.632±2.152abNH+4-N9.762±0.906A0.218±0.026B45.295±6.710A0.01NO-3-N2.791±0.064bc0.339±0.030b8.286±0.902bNH+4-N8.774±0.084B0.225±0.016B39.108±2.357AB0.03NO-3-N2.576±0.192c0.533±0.033a4.856±0.653cNH+4-N8.151±0.384B0.337±0.030A24.361±3.366C
注:MC-LR、Vmax和Km分别表示微囊藻毒素-LR、最大吸收速率和米氏常数;上标不同大写和小写字母分别表示![]() 和
和![]() 吸收动力学参数间差异显著(P<0.05)。
吸收动力学参数间差异显著(P<0.05)。
Note: MC-LR, Vmax and Km represent microcystin-leucine-arginine, the maximum uptake rate and Michaelis constant, respectively; different uppercase and lowercase letters indicated significant differences in kinetic parameters of ![]() uptake, respectively.
uptake, respectively.
综上所述,环境不同浓度MC-LR暴露对菖蒲无机氮吸收会产生不同程度的影响,具体表现为:0.001 mg·L-1 MC-LR暴露增加了菖蒲根系活力和根系PM H+-ATP酶活性,增强了菖蒲对![]() 和
和![]() 的吸收;0.01 mg·L-1 MC-LR暴露对菖蒲根系产生了轻度胁迫,但没有产生明显的损伤,增强了菖蒲对
的吸收;0.01 mg·L-1 MC-LR暴露对菖蒲根系产生了轻度胁迫,但没有产生明显的损伤,增强了菖蒲对![]() 的吸收,降低了菖蒲对
的吸收,降低了菖蒲对![]() 的亲和力和吸收潜能;0.03 mg·L-1 MC-LR暴露导致菖蒲根系受到严重的氧化胁迫,根系生长受到抑制,降低了菖蒲对
的亲和力和吸收潜能;0.03 mg·L-1 MC-LR暴露导致菖蒲根系受到严重的氧化胁迫,根系生长受到抑制,降低了菖蒲对![]() 和
和![]() 的吸收潜能和亲和力,减弱了菖蒲对
的吸收潜能和亲和力,减弱了菖蒲对![]() 和
和![]() 的吸收,而且与
的吸收,而且与![]() 相比,MC-LR对
相比,MC-LR对![]() 吸收的抑制作用更强。因此,富营养化水体中低浓度的MC-LR有利于菖蒲的生长和对无机氮的吸收,而较高浓度的MC-LR将抑制菖蒲对无机氮的吸收,从而会对其生长及氮的去除能力产生不利影响。
吸收的抑制作用更强。因此,富营养化水体中低浓度的MC-LR有利于菖蒲的生长和对无机氮的吸收,而较高浓度的MC-LR将抑制菖蒲对无机氮的吸收,从而会对其生长及氮的去除能力产生不利影响。
[1] Achal V, Mukherjee A. Ecological Wisdom Inspired Restoration Engineering [M]. Singapore: Springer, 2019: 181-195
[2] 彭婉婷, 邹琳, 段维波, 等. 多种湿地植物组合对污水中氮和磷的去除效果[J]. 环境科学学报, 2012, 32(3): 612-617
Peng W T, Zou L, Duan W B, et al. Efficiency of nitrogen and phosphorus removal from sewage by various combinations of wetland plants [J]. Acta Scientiae Circumstantiae, 2012, 32(3): 612-617 (in Chinese)
[3] Hammou H A, Latour D, Samoudi S, et al. Occurrence of the first toxic microcystis bloom in a recent Moroccan Reservoir [J]. Water Resources, 2018, 45(3): 409-417
[4] Puddick J, Prinsep M R, Wood S A, et al. Further characterization of glycine-containing microcystins from the McMurdo Dry Valleys of Antarctica [J]. Toxins, 2015, 7(2): 493-515
[5] Wu J, Shao S J, Zhou F, et al. Reproductive toxicity on female mice induced by microcystin-LR [J]. Environmental Toxicology and Pharmacology, 2014, 37(1): 1-6
[6] Hu X B, Zhang R F, Ye J Y, et al. Monitoring and research of microcystins and environmental factors in a typical artificial freshwater aquaculture pond [J]. Environmental Science and Pollution Research, 2018, 25(6): 5921-5933
[7] Major Y, Kifle D, Spoof L, et al. Cyanobacteria and microcystins in Koka Reservoir (Ethiopia) [J]. Environmental Science and Pollution Research International, 2018, 25(27): 26861-26873
[8] 刘佳, 黄哲旖, 胡馨月, 等. 微囊藻毒素与鱼腥藻毒素对生菜活性氧稳态的复合影响[J]. 环境化学, 2022, 41(11): 3738-3745
[9] Dong J, Dai D J, Yang Y, et al. Responses of submerged macrophyte Ceratophyllum demersum to the gradient concentrations of microcystin-LR (MC-LR) [J]. Environmental Science and Pollution Research, 2022, 29(47): 71257-71269
[10] Chen S H, Jiang J L, Long T, et al. Oxidative stress induced in rice suspension cells exposed to microcystin-LR at environmentally relevant concentrations [J]. Environmental Science and Pollution Research International, 2021, 28(28): 38393-38405
[11] Chen G Y, Zheng Z H, Bai M X, et al. Chronic effects of microcystin-LR at environmental relevant concentrations on photosynthesis of Typha angustifolia Linn [J]. Ecotoxicology, 2020, 29(5): 514-523
[12] Zhang Y Y, Duy S V, Munoz G, et al. Phytotoxic effects of microcystins, anatoxin-a and cylindrospermopsin to aquatic plants: A meta-analysis [J]. The Science of the Total Environment, 2022, 810: 152104
[13] 陈国元, 廖腾芳, 李青松. 微囊藻毒素-LR慢性暴露对水雍菜光合生理的影响[J]. 西北农林科技大学学报(自然科学版), 2021, 49(9): 129-136, 143
Chen G Y, Liao T F, Li Q S. Effects of chronic exposure to microcystin-LR on photosynthetic physiology of Ipomoea aquatica [J]. Journal of Northwest A &F University (Natural Science Edition), 2021, 49(9): 129-136, 143 (in Chinese)
[14] Gao Y N, Yang H, Gao X F, et al. Ecological damage of submerged macrophyte Myriophyllum spicatum by cell extracts from microcystin (MC)- and non-MC-producing cyanobacteria, microcystis [J]. Journal of Oceanology and Limnology, 2022, 40(5): 1732-1749
[15] Machado J, Azevedo J, Freitas M, et al. Analysis of the use of microcystin-contaminated water in the growth and nutritional quality of the root-vegetable, Daucus carota [J]. Environmental Science and Pollution Research International, 2017, 24(1): 752-764
[16] Claassen N, Barber S A. A method for characterizing the relation between nutrient concentration and flux into roots of intact plants [J]. Plant Physiology, 1974, 54(4): 564-568
[17] Hajari E, Snyman S J, Watt M P. Inorganic nitrogen uptake kinetics of sugarcane (Saccharum spp.) varieties under in vitro conditions with varying N supply [J]. Plant Cell, Tissue and Organ Culture, 2014, 117(3): 361-371
[18] Huang Q Q, Yu Y, Wang Q, et al. Uptake kinetics and translocation of selenite and selenate as affected by iron plaque on root surfaces of rice seedlings [J]. Planta, 2015, 241(4): 907-916
[19] Malea P, Kevrekidis T, Chatzipanagiotou K R, et al. Cadmium uptake kinetics in parts of the seagrass Cymodocea nodosa at high exposure concentrations [J]. Journal of Biological Research, 2018, 25: 5
[20] 陈国元, 廖杰, 何彩庆, 等. 低浓度微囊藻毒素MC-LR对梭鱼草幼苗根系![]() 和H2PO4-吸收特性的影响[J]. 植物资源与环境学报, 2018, 27(3): 33-40
和H2PO4-吸收特性的影响[J]. 植物资源与环境学报, 2018, 27(3): 33-40
Chen G Y, Liao J, He C Q, et al. Effects of low concentrations of microcystin MC-LR on ![]() and H2PO4- absorption characteristics of root of Pontederia cordata seedling [J]. Journal of Plant Resources and Environment, 2018, 27(3): 33-40 (in Chinese)
and H2PO4- absorption characteristics of root of Pontederia cordata seedling [J]. Journal of Plant Resources and Environment, 2018, 27(3): 33-40 (in Chinese)
[21] Luo H H, Zhang Y L, Zhang W F. Effects of water stress and rewatering on photosynthesis, root activity, and yield of cotton with drip irrigation under mulch [J]. Photosynthetica, 2016, 54(1): 65-73
[22] Gay C A, Gebicki J M. Measurement of protein and lipid hydroperoxides in biological systems by the ferric-xylenol orange method [J]. Analytical Biochemistry, 2003, 315(1): 29-35
[23] 中国科学院上海植物生理研究所. 现代植物生理学实验指南[M]. 北京: 科学出版社, 1999: 138-306
[24] Falhof J, Pedersen J, Fuglsang A, et al. Plasma membrane H+-ATPase regulation in the center of plant physiology [J]. Molecular Plant, 2016, 9(3): 323-337
[25] Chen H F, Zhang Q, Cai H M, et al. Ethylene mediates alkaline-induced rice growth inhibition by negatively regulating plasma membrane H+-ATPase activity in roots [J]. Frontiers in Plant Science, 2017, 8: 1839
[26] Loss Sperandio M V, Santos L A, Huertas Tavares O C, et al. Silencing the Oryza sativa plasma membrane H+-ATPase isoform OsA2 affects grain yield and shoot growth and decreases nitrogen concentration [J]. Journal of Plant Physiology, 2020, 251: 153220
[27] 李旭霞, 荣湘民, 谢桂先, 等. 不同水生植物吸收地表水中氮磷能力差异及其机理[J]. 水土保持学报, 2018, 32(1): 259-263
Li X X, Rong X M, Xie G X, et al. Difference in absorbability of different aquatic plants on N and P in surface water and its mechanism [J]. Journal of Soil and Water Conservation, 2018, 32(1): 259-263 (in Chinese)
[28] Mengel K, Robin P, Salsac L. Nitrate reductase activity in shoots and roots of maize seedlings as affected by the form of nitrogen nutrition and the pH of the nutrient solution [J]. Plant Physiology, 1983, 71(3): 618-622
[29] Chen G Y, Li Q S, Bai M X, et al. Nitrogen metabolism in Acorus calamus L. leaves induced changes in response to microcystin-LR at environmentally relevant concentrations [J]. Bulletin of Environmental Contamination and Toxicology, 2019, 103(2): 280-285
[30] Li Y, Gao Y X, Ding L, et al. Ammonium enhances the tolerance of rice seedlings (Oryza sativa L.) to drought condition [J]. Agricultural Water Management, 2009, 96(12): 1746-1750
[31] Ding L, Gao C M, Li Y R, et al. The enhanced drought tolerance of rice plants under ammonium is related to aquaporin (AQP) [J]. Plant Science, 2015, 234: 14-21
[32] Zhang C X. Net ![]() transporter genes in roots of Populus simonii after acclimation to moderate salinity [J]. Trees, 2014, 28(6): 1813-1821
transporter genes in roots of Populus simonii after acclimation to moderate salinity [J]. Trees, 2014, 28(6): 1813-1821
[33] Jampeetong A, Brix H. Nitrogen nutrition of Salvinia natans: Effects of inorganic nitrogen form on growth, morphology, nitrate reductase activity and uptake kinetics of ammonium and nitrate [J]. Aquatic Botany, 2009, 90(1): 67-73
[34] Nishikawa T, Tarutani K, Yamamoto T. Nitrate and phosphate uptake kinetics of the harmful diatom Coscinodiscus wailesii, a causative organism in the bleaching of aquacultured Porphyra thalli [J]. Harmful Algae, 2010, 9(6): 563-567