20世纪70年代,科研人员在烟碱的基础上开发出了新烟碱类杀虫剂,因其低毒、高效等特性,被广泛使用[1]。新烟碱类杀虫剂能够通过激活昆虫体内的神经元使其发生去极化,使昆虫因神经系统过度兴奋而死亡[2]。新烟碱类杀虫剂的作用时间较长,降解缓慢,可在环境残留1 d~19 a不等[3],且可以被植物根部吸收存在于植物各个部位,不能通过剥皮和水洗去除,能够在食物中长期残留,因此在蔬菜[4]、土壤[5]和地下水[6]等非靶标植物和动物体内均能被检出[7]。目前,啶虫脒(ACE)作为氯代新烟碱型杀虫剂被广泛使用。有研究发现[8],通过对水生环境监测得到的美国德克萨斯州高平原Playa湿地中的ACE,浓度高达225 μg·L-1。尽管新烟碱类杀虫剂的环境残留剂量较低,但近些年来环境介质中新烟碱类杀虫剂的环境残留剂量正在呈逐年上升趋势,这应当引起我们足够的重视。根据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations, FAO)标准[9],结合长达2年的大鼠毒性和致癌性实验,设立ACE人群每日允许摄入量为0~0.07 mg·kg-1。还有研究发现[10],长期接触使用新烟碱类杀虫剂的人员可以在尿液中检出其代谢产物。Wang等[11]根据上海市儿童尿液中新烟碱含量,推测出新烟碱最大暴露剂量为10.61 μg·kg-1。近期相关研究显示[12],ACE暴露1 h后在小鼠大脑中检测到ACE及其代谢物。另有研究表明[13],ACE能够在肠道中被完全吸收并且可以通过血脑屏障,长期接触后能够以剂量依赖的方式在体内累积,在不同脑区蓄积,对哺乳动物神经系统可能具有危害[14]。出生后10 d左右为大鼠脑发育突发期[15],此时大脑发育未完全,容易受到环境和药物暴露后的副作用影响。研究表明[16],口服ACE(5 mg·kg-1)可以显著降低新生小鼠的神经干细胞增殖基因(C1DU)、神经元数目,并增加了小胶质细胞的产生,表明新生小鼠海马区神经发生受损。然而对于新生期大鼠ACE亚慢性暴露是否会影响其成年后神经行为变化尚不清楚[17]。因此,本研究拟通过ACE对新生大鼠亚慢性暴露,观察其对成年后神经行为、大脑皮质和海马组织的影响。
1 材料与方法(Materials and methods)
1.1 实验动物及分组
选择出生7 d的雄性SD大鼠18只,体质量为(35±5) g,由宁夏医科大学实验动物中心提供,实验动物质量许可证SCXK(宁)2020-0001。待母鼠适应性饲养1周后,随机分为3组(每组6只),出生20 d断奶后分笼,每笼3只。分别设对照组(Control)、ACE-15组(15 mg·kg-1)和ACE-40组(40 mg·kg-1)。每天每只大鼠经口灌胃一次,对照组给予等量玉米油溶剂,连续灌胃9周。实验期间大鼠自由饮水、摄食,饲养环境温度18~22 ℃,湿度40%~70%,每日12 h光照12 h黑暗。
1.2 主要试剂与仪器
啶虫脒(纯度99%,中国北京伊塔生物科技有限公司),SOD测定试剂盒(A001-2-2,中国南京建成生物工程研究所),MDA测定试剂盒(A003-1-2,中国南京建成生物工程研究所),BCA蛋白测定试剂盒(KGP903,中国江苏凯基生物技术股份有限公司),Nissl染色试剂盒(G1430,中国北京索莱宝科技有限公司),兔抗多克隆抗体IL-10(DF6894,美国Affinity Biosciences公司),兔抗多克隆抗体IL-1β(AF5103,美国Affinity Biosciences公司),β-actin(DF13469,美国Affinity Biosciences公司),辣根酶标记山羊抗兔IgG(ZB-2301,北京中山金桥生物技术有限公司),垂直式蛋白电泳仪(Amersham,Imager600,美国Bio-Rad公司),ECL发光法成像系统(Power Pac Basic,美国Thermo Fisher Scientific公司),图像采集系统显微镜(BX51TF,日本Olympus公司)。
1.3 实验方法
1.3.1 大鼠行为学检测
开放旷场(OFT)实验在长100 cm×宽100 cm×高40 cm的无盖方形箱子中进行,将底部平均分为25个方格(5×5),中间9个方格(3×3)定义为中央区。应用SMART 3.0软件记录10 min内大鼠的运动轨迹、距离及时间等参数。
Morris水迷宫(MWM)实验在直径为1.2 m的圆形水池进行。将水池平均分为4个象限,平台放置于第3象限。定位航行期:前4天,每天将大鼠分别从4个不同象限面向池壁放入水中,应用SMART 3.0软件记录大鼠在1 min内找到平台的时间(逃逸潜伏期)。若超过1 min未能找到平台,则引导大鼠到平台上适应30 s。空间探索期:第5天撤去平台,将大鼠从第3象限面向池壁放入水中,应用SMART 3.0软件记录大鼠在1 min内跨平台次数和目标象限游泳速度。
1.3.2 大鼠大脑皮质和海马组织MDA浓度、SOD活性测定
使用七氟烷将大鼠麻醉后,迅速剪开胸腹腔,充分暴露心脏,使用注射器经右心耳采集血液,收集于2 mL离心管中,静置离心(3 600 r·min-1, 10 min),取上层清液,按照试剂盒说明书及计算公式,测定大鼠大脑皮质和海马组织中MDA浓度、SOD活性。
1.3.3 Western Blot检测大鼠大脑皮质和海马组织中IL-10、IL-1β的蛋白表达量
按照说明书步骤提取大鼠大脑皮质和海马组织蛋白并进行蛋白定量,蛋白上样量为40 μg。经质量分数为8%~15% SDS PAGE凝胶电泳分离蛋白,转移蛋白至PVDF膜上,5%脱脂奶粉室温封闭2 h。用TBST液漂洗3次,每次10 min;4 °C冰箱一抗(1∶2 000)孵育过夜,TBST液漂洗3次,每次10 min;室温下二抗(1∶5 000)孵育1 h,TBST液漂洗3次,每次10 min,ECL发光法成像,Image J 1.52软件计算其灰度值并进行统计学分析。
1.3.4 制备石蜡切片及染色
H&E染色:将切片取出平衡至室温,之后依次放入二甲苯Ⅰ、二甲苯Ⅱ各反应10 min;连续下行酒精梯度各3 min;自来水冲洗2 min;苏木素染液浸染6 min;自来水冲洗6 min;盐酸酒精分化液分化1 s,流水冲洗5 min;伊红染液染色7 min,流水冲洗3 min;连续上行酒精梯度各2 min;二甲苯Ⅰ、二甲苯Ⅱ各10 min;中性树脂封片。采用Olympus系统观察染色结果。
Nissl染色:将切片取出平衡至室温,之后依次放入二甲苯Ⅰ、二甲苯Ⅱ各反应10 min;连续下行酒精梯度各3 min;自来水冲洗2 min;将载玻片放入Nissl试剂盒中的试剂A液中,56 ℃浸染1 h;之后取出载玻片用纯水清洗3遍,每次1 min;将载玻片放入Nissl试剂盒中的试剂B液中分化40 s;连续上行酒精梯度各1 min;二甲苯Ⅰ、二甲苯Ⅱ各反应5 min;中性树脂封片。采用Olympus系统观察染色结果。
1.4 统计学方法
数据采用Graphpad 8.0软件进行统计学分析,实验数据均用![]() 表示。所有数据先进行方差校验,符合正态分布后进行统计分析。多组间比较用单因素方差分析(One-way ANOVA),两两比较用Dunnet t法,P<0.05具有统计学差异。
表示。所有数据先进行方差校验,符合正态分布后进行统计分析。多组间比较用单因素方差分析(One-way ANOVA),两两比较用Dunnet t法,P<0.05具有统计学差异。
2 结果(Results)
2.1 一般状态及体质量变化情况
大鼠ACE暴露9周的体质量变化趋势如图1所示,ACE干预后每周称量一次空腹体质量,前6周各组体质量稳定上涨无明显差异;第7周、第8周和第9周,与对照组相比,ACE暴露组大鼠体质量上涨均明显下降,具统计学意义(P<0.05、P<0.01、P<0.001)。对照组大鼠摄食、饮水和精神状态一般状况良好,毛发顺滑,而ACE暴露组大鼠毛发粗糙,顺滑度下降。
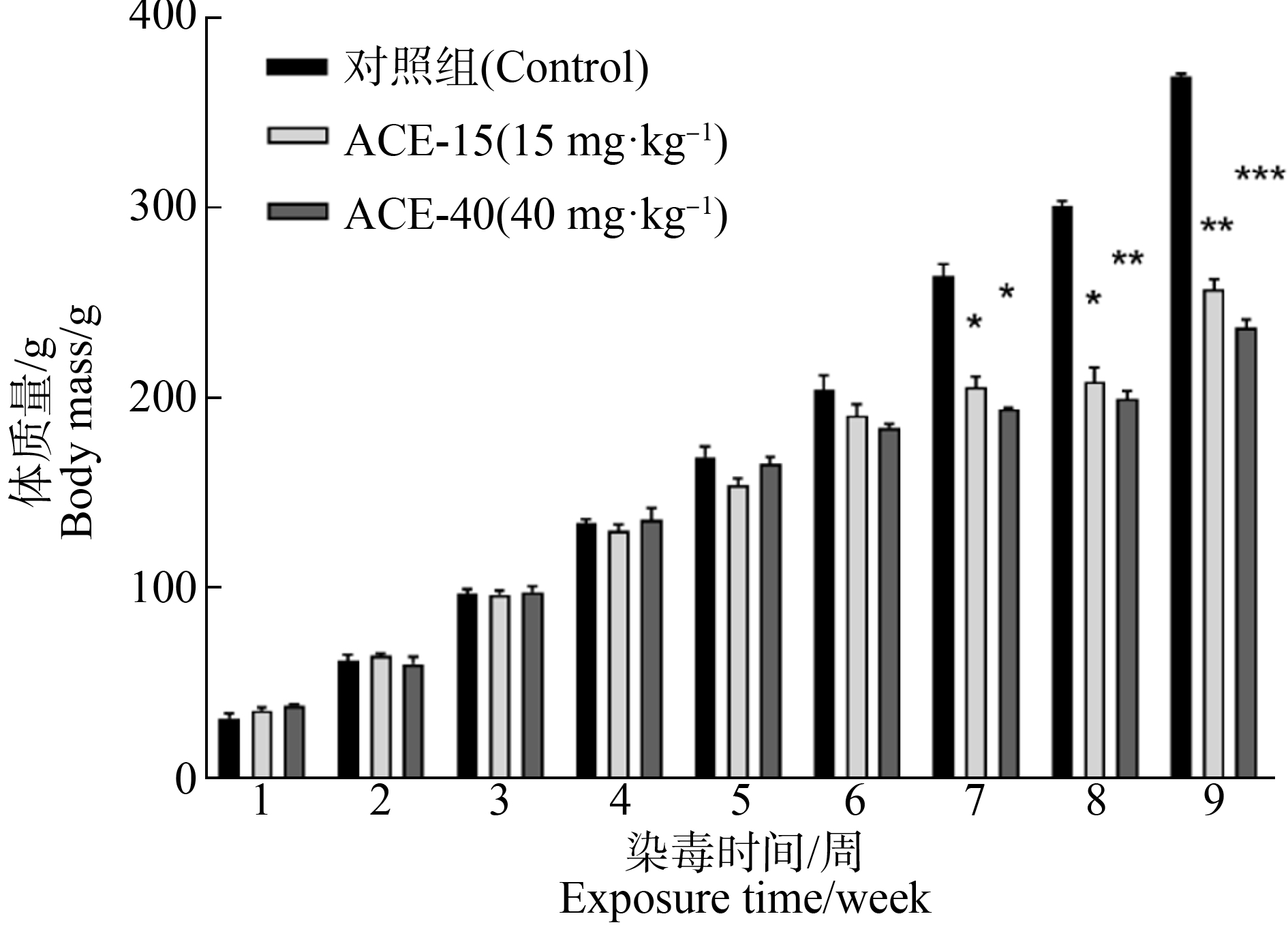
图1 啶虫脒(ACE)暴露9周大鼠体质量变化![]()
注:与对照组比较,*表示P<0.05,**表示P<0.01,***表示P<0.001。
Fig. 1 The effect of acetamiprid (ACE) on the mean body weight of SD rat ![]() n=6)
n=6)
Note: Compared with control group, *represents P<0.05, **represents P<0.01, and ***represents P<0.001.
2.2 行为学实验
2.2.1 开放旷场实验(OFT)
图2(a)展示的是3组大鼠在OFT实验中的典型轨迹图;图2(b)展示的是3组大鼠旷场内的总运动距离统计结果。与对照组比较,ACE-40组大鼠的运动距离显著减少(P<0.05);图2(c)展示的是3组大鼠在中央区运动距离统计结果。与对照组比较,ACE-40组大鼠在中央区运动距离明显减少(P<0.01);图2(d)展示了大鼠在中央区运动时间统计结果。与对照组比较,ACE-15组(P<0.05)和ACE-40组(P<0.05)大鼠在中央区运动时间明显减少。

图2 ACE暴露下各组大鼠的OFT实验结果![]()
注:(a) 大鼠在OFT实验中的典型轨迹图;(b) 运动总距离;(c) 中央区移动距离;(d) 中央区运动时间;*表示P<0.05,**表示P<0.01。
Fig. 2 OFT results of SD rat after exposed to ACE ![]() n=6)
n=6)
Note: (a) Trajectories of SD rat after treated with ACE in OFT; (b) Total distance; (c) Movement distance in central area; (d) Duration of movement in the central area; *represents P<0.05, and **represents P<0.01.
2.2.2 Morris水迷宫(MWM)
3组大鼠逃逸潜伏期统计结果如图3(a)所示。与对照组比较,ACE暴露组逃逸潜伏期变长(P<0.01),与ACE-15组比较,ACE-40组逃逸潜伏期明显延长(P<0.05);3组大鼠在目标象限停留时间统计结果如图3(b)所示。与对照组比较,ACE暴露组在目标象限停留时间减少(P<0.05、P<0.01)。3组大鼠在MWM空间探索期典型轨迹图如图4(a)所示;跨平台次数统计结果如图4(b)所示。与对照组比较,ACE-40组跨平台次数减少(P<0.01),与ACE-15组比较,ACE-40组明显减少(P<0.01);3组大鼠在平台所在象限的游泳速度统计结果如图4(c)所示。与对照组比较,ACE暴露组游泳速度明显减慢,其中ACE-15组(P<0.05)和ACE-40组(P<0.01)均与对照差异显著。
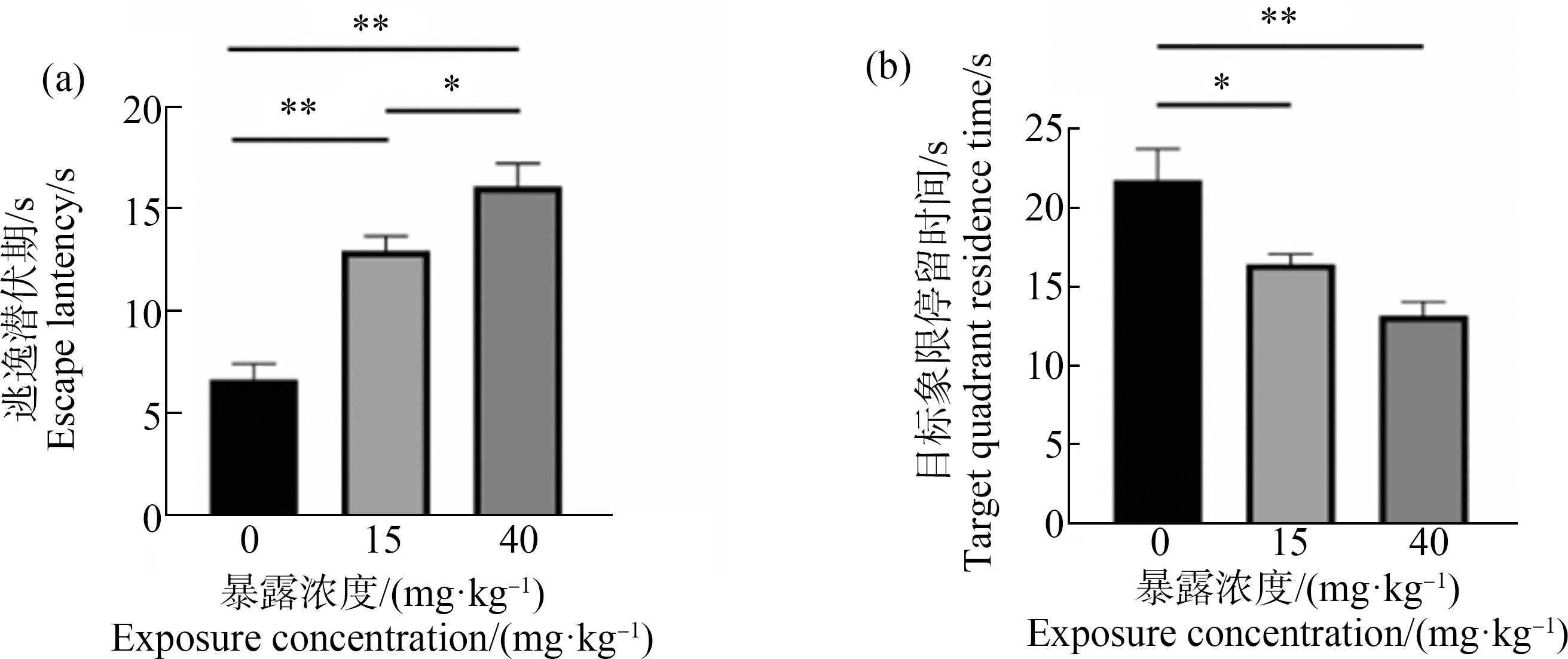
图3 ACE暴露下各组大鼠的MWM定位巡航期实验结果![]()
注:(a) 逃逸潜伏期;(b) 目标现象停留时间;*表示P<0.05,**表示P<0.01。
Fig. 3 Results of SD rat after exposed to ACE in MWM of positioning cruise period ![]() n=6)
n=6)
Note: (a) Escape latency; (b) Target quadrant residence time; * represents P<0.05, and **represents P<0.01.

图4 ACE暴露下各组大鼠的MWM空间探索期实验结果![]()
注:(a) 大鼠在MWM实验中的轨迹图;(b) 跨平台次数;(c) 目标现象游泳速度;*表示P<0.05,**表示P<0.01。
Fig. 4 Results of SD rat after exposed to ACE in MWM of space exploration period ![]() n=6) Note: (a) Trajectories of SD rat after treated with ACE in MWM; (b) Target crossing; (c) Swimming speed in the target quadrant; *represents P<0.05, and **represents P<0.01.
n=6) Note: (a) Trajectories of SD rat after treated with ACE in MWM; (b) Target crossing; (c) Swimming speed in the target quadrant; *represents P<0.05, and **represents P<0.01.
2.3 氧化应激相关指标及抗氧化酶活性测定
如图5所示,与对照组比较,ACE暴露组大鼠大脑皮质组织MDA浓度升高,ACE-40组(P<0.05)。与ACE-15组比较,ACE-40组MDA浓度显著升高(P<0.01)。ACE暴露组海马组织中MDA浓度也升高,ACE-15组和ACE-40组均与之差异显著(P<0.01)。

图5 ACE暴露下大鼠皮质和海马组织中MDA浓度检测结果![]()
注:*表示P<0.05,**表示P<0.01。
Fig. 5 Results of MDA concentration in the brain cortex and hippocampus of SD rat after exposure to ACE ![]() n=6)
n=6)
Note: *represents P<0.05, and **represents P<0.01.
ACE暴露后大鼠大脑皮质(a)和海马(b)中的SOD活性如图6所示,与对照组比较,ACE-40组大鼠大脑皮质组织SOD活性显著减少。而海马组织SOD活性升高,ACE-15组、ACE-40组与对照差异具有统计学意义(P<0.01)。
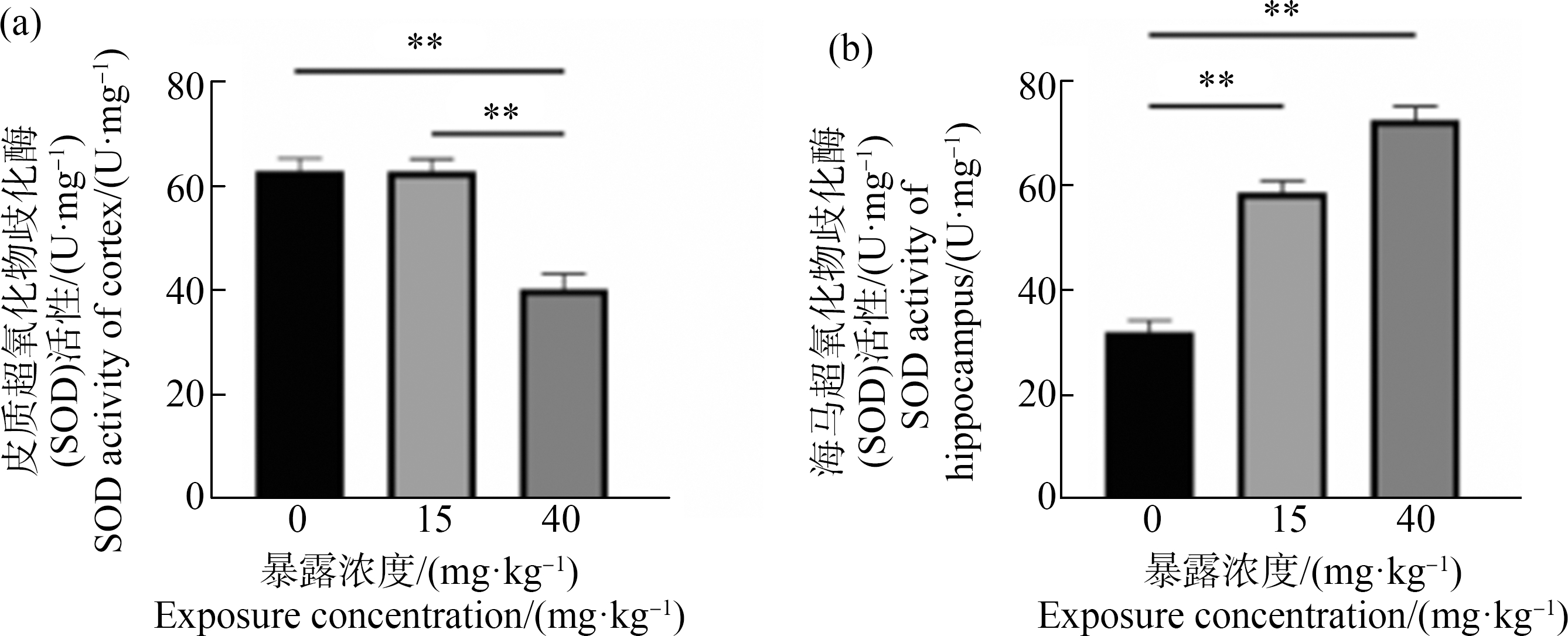
图6 ACE暴露下大鼠皮质和海马组织中SOD活性检测结果![]()
注:**表示P<0.01。
Fig. 6 Results of SOD activity assay in the brain cortex and hippocampus of SD rat after exposure to ACE ![]() n=6)
n=6)
Note: **represents P<0.01.
2.4 Western Blot检测大鼠大脑皮质和海马组织中IL-1β、IL-10蛋白表达量结果
如图7所示,与对照组比较,皮质中IL-1β蛋白表达量在ACE-15组和ACE-40组均增高(P<0.01);而IL-10蛋白表达含量均降低(P<0.01、P<0.001),与ACE-15组比较,ACE-40组IL-10表达量明显减少(P<0.01)。海马中IL-1β蛋白表达量在ACE-15组和ACE-40组均增高(P<0.01、P<0.001);而IL-10蛋白表达含量均降低(P<0.01、P<0.001),与ACE-15组比较,ACE-40组IL-10表达量明显减少(P<0.01)。
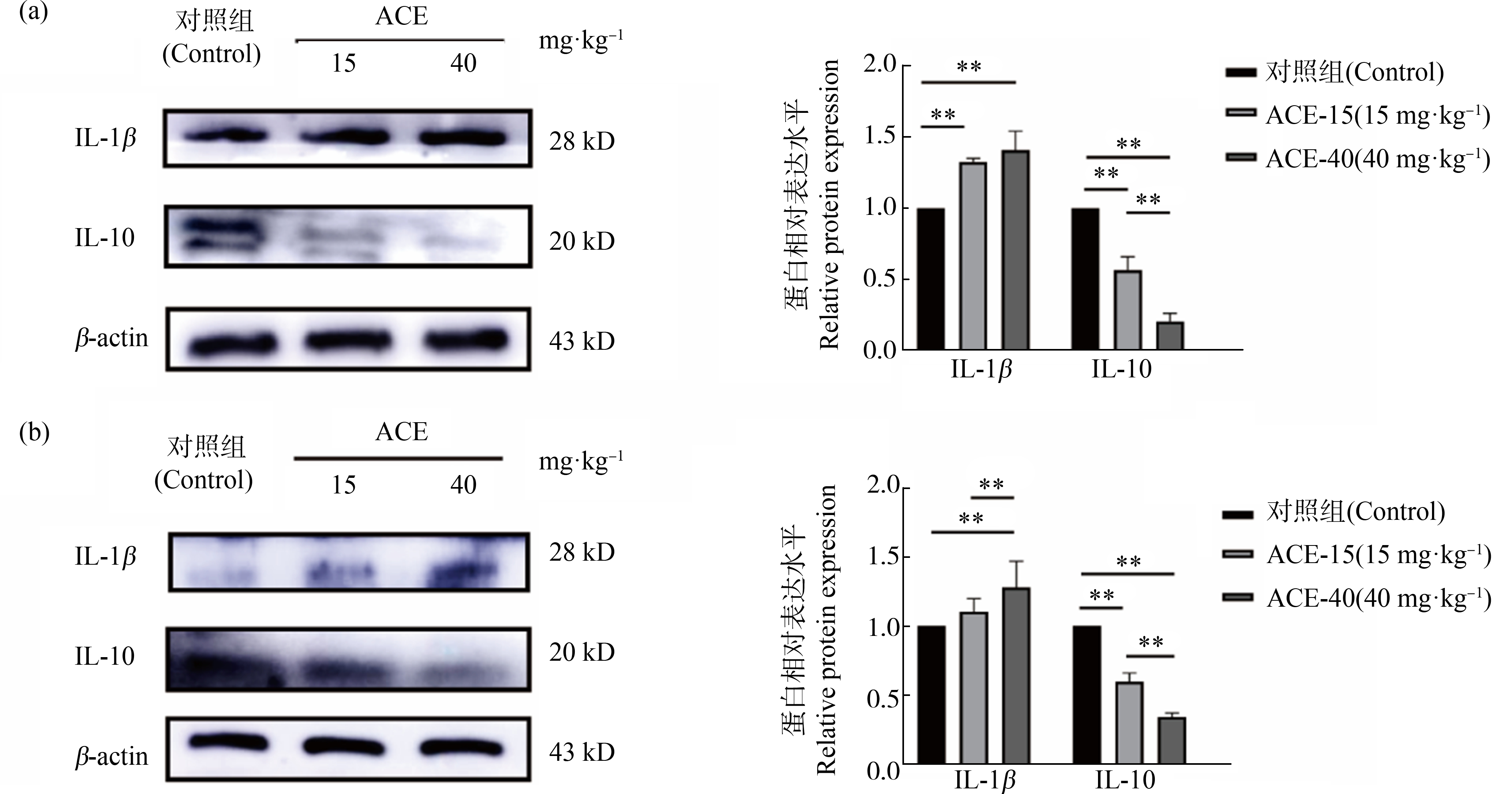
图7 ACE暴露下大鼠皮质和海马组织中IL-1β、IL-10蛋白表达量![]()
注:(a) 大鼠皮质组织中IL-1β、IL-10蛋白表达量;(b) 大鼠海马组织中IL-1β、IL-10蛋白表达量;**表示P<0.01。
Fig. 7 Expression of IL-1β and IL-10 protein in cortical and hippocampal tissues of rats exposed to ACE ![]() n=6)
n=6)
Note: (a) IL-1β, IL-10 level in the cortex; (b) IL-1β, IL-10 level in the hippocampus; **represents P<0.01.
2.5 组织病理学
ACE暴露下大鼠大脑海马形态结构上的变化如图8所示,H&E结果显示,与对照组比较,ACE-40组DG、CA3区出现神经元排列紊乱、稀疏和轮廓模糊等现象。ACE暴露下大鼠大脑海马神经元情况如图9所示,Nissl结果显示,与对照组比较,ACE暴露组海马DG、CA3区神经元数量减少。

图8 H&E染色:大鼠海马DG、CA3区显微结构图
注:(a), (d) 对照组;(b), (e) 15 mg·kg-1;(c), (f) 40 mg·kg-1;标尺=40 μm,n=6;黑色箭头表示细胞结构松散。
Fig. 8 H&E staining: Microstructure of DG, CA3 region of rat hippocampus
Note: (a), (d) Control group; (b), (e) 15 mg·kg-1; (c), (f) 40 mg·kg-1; the bar=40 μm, n=6; the black arrows indicate loose cell structure.
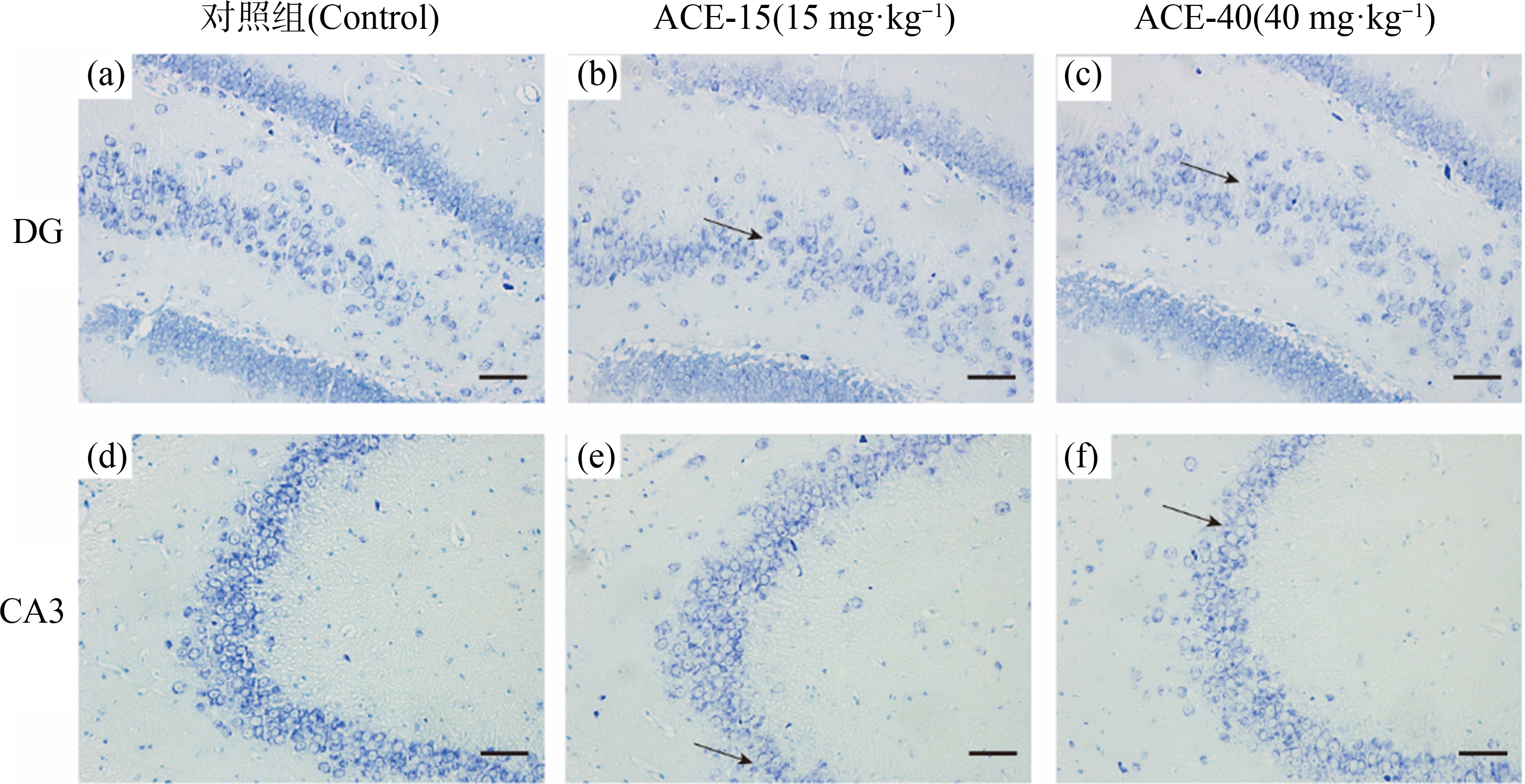
图9 Nissl染色:大鼠海马DG、CA3区显微结构图
注:(a), (d) 对照组;(b), (e) 15 mg·kg-1;(c), (f) 40 mg·kg-1;标尺=40 μm,n=6;黑色箭头表示尼氏小体消失。
Fig. 9 Nissl staining: Microstructure of DG, CA3 region of rat hippocampus
Note:(a), (d) Control group; (b), (e) 15 mg·kg-1; (c), (f) 40 mg·kg-1; the bar=40 μm, n=6; the black arrows indicate the disappearance of Nissl body.
3 讨论(Discussion)
自新烟碱类杀虫剂问世以来,新烟碱已成为杀虫剂市场发展速度最快,使用率最高的杀虫剂之一,目前约占市场的1/3[18]。然而这类杀虫剂在发挥杀虫除草作用的同时,对环境[19]和非靶标动物[20]也具有危害。目前,已有新烟碱类杀虫剂暴露对哺乳动物造成多方面损伤的研究报道。Gasmi等[21]将成年大鼠ACE (3.14 mg·kg-1)暴露90 d后,发现线粒体结构损伤,呼吸链功能紊乱。Karaca等[22]将8~10周龄雄性SD大鼠进行ACE (25 mg·kg-1、35 mg·kg-1)暴露90 d后,肝肾功能出现一定的损伤。
Kagawa和Nagao[23]将孕期小鼠经口ACE (5 mg·kg-1)暴露发现,在胚胎期第6天到第13天间小鼠皮质发育不全,神经发生减少,这提示孕期ACE暴露会对发育中的神经系统产生毒性作用。Dhouib等[24]对大鼠进行ACE (40 mg·kg-1)连续口服21 d实验,暴露后进行斜板测试和前爪握力测试,结果显示ACE(40 mg·kg-1)暴露能够产生对大鼠神经肌肉接头毒性作用。在海马体中,胆碱能系统对空间学习和记忆形成等认知功能起着至关重要的作用。Shamsi等[25]认为ACE对哺乳动物的n型乙酰胆碱受体(nAChR)具有显著的亲和性,是导致哺乳动物学习记忆减退的原因。而出生后早期ACE暴露,是否对其成年后学习记忆等认知功能产生影响,尚不清楚。因此,本研究采用OFT和MWM进行学习记忆与情绪变化的测试。
研究表明,行为变化是一种早期和敏感的毒理学指标[26]。OFT是探究动物在新环境中的焦虑行为和空间探索度的方法。已知ACE暴露会改变大鼠的社会性和焦虑行为,成年大鼠口服ACE平均剂量10 mg·kg-1,连续7 d,情境恐惧条件和修正降压行为模型下均表现出学习记忆障碍[27]。本研究OFT结果显示,大鼠在中央区运动距离和时间较对照组均减少了,表明ACE的干预对大鼠的精神状态造成了一定影响,大鼠探究行为受到ACE的抑制,回避和焦虑水平增高,适应环境能力下降。MWM是评价动物空间学习记忆与认知功能的实验。MWM结果显示,在定位巡航期间,ACE暴露组逃逸潜伏期时间明显延长,表明新生大鼠在亚慢性ACE暴露后,成年期的学习记忆能力变差;在空间探索期,ACE-40组跨平台次数明显减少,表明口服ACE 40 mg·kg-1对大鼠新生期至成年阶段的空间记忆能力造成影响。行为学结果说明ACE亚慢性暴露能够对大鼠的认知行为造成影响。Ford和Casida[28]的研究表明,与ACE同属新烟碱类杀虫剂的吡虫啉可以透过血脑屏障且蓄积在脑内,影响相应的蛋白表达,造成海马功能下降,表现为学习记忆等行为异常。Abd-Elhakim等[29]的研究表明,吡虫啉可造成大鼠在孔板实验和斜面实验中出现神经毒性表现。Bhardwaj等[30]的研究也发现长期暴露于吡虫啉的大鼠神经行为学实验表现异常,包括行进距离、运动时间等自发运动显著减少,这些研究结果都与本研究的结果一致。本研究中H&E与Nissl结果显示ACE-40组的海马神经元较对照组出现形态结构等变化,说明ACE 40 mg·kg-1对大鼠的海马神经元结构造成破坏,这与行为学的结果相对应。
诸多研究表明,传统杀虫剂在体内代谢会产生活性氧(ROS)等产物,造成脂质过氧化,导致MDA的产生[31]。MDA是反映有害物质对生物体细胞氧化损伤的重要指标。大脑含有丰富的过氧化物脂肪酸,抗氧化能力相对较弱,因此特别容易受到氧化损伤[32]。在细胞水平上,ACE暴露可能以剂量依赖性的方式导致氧化应激介导的抗氧化状态改变[33]。本实验结果显示,ACE暴露后大脑皮质和海马均发生脂质过氧化,ACE暴露组MDA浓度较对照组明显升高。SOD是机体中一种重要的抗氧化酶,在本实验中脑皮质的SOD活性降低,而海马组织中SOD活性却上升。Gasmi等[21]研究的结果也显示在海马组织中SOD活性上升。Panemangalore和Bebe[34]的研究显示,氧化产物的增加会导致SOD活性的抑制。Terayama等[35]研究显示,ACE在皮质和髓质、间脑、海马和纹状体中积累量不同。当积累量达到一定程度时机体抗氧化系统的代偿功能丧失,造成SOD的活性抑制,这可能是SOD在不同脑区活性不一致的原因,进一步支持了本研究结果。
已有研究显示,氧化应激可以增加炎症反应,炎症也可以加重氧化应![]() 炎症因子IL-1β可以反映机体炎症水平和组织的损伤程度[37]。Western Blot实验结果显示大脑皮质和海马组织中的IL-1β在ACE暴露组中均上升,抑炎因子IL-10在ACE暴露组中减少,表明新生大鼠ACE亚慢性暴露能引起中枢神经系统炎症反应。之前有研究显示[38],ACE干预可以引起体内B细胞等免疫细胞增殖下调,免疫防御作用降低,产生氧化应激反应,使免疫细胞功能下降,激活巨噬细胞转变成M1型,促进炎症因子产生。有研究明确了炎症因子对神经元的损伤作用[39],因此,ACE 40 mg·kg-1的干预引起海马和皮质组织炎症的上调,造成神经元损害,从而出现行为与认知的改变。目前研究表明,ROS在炎症反应中起到第二信使的作用,能够促进炎症反应的发生。Santhanasabapathy等[40]研究发现在大鼠脑组织中氧化应激反应的发生伴有星形胶质细胞及小胶质细胞的激活,以及促炎因子IL-lβ、TNF-a和iNOS的表达升高,同时在大脑皮层、海马及纹状体中观察到神经退行性病变的发生,也与我们的研究结果一致。氧化应激与炎症的联系最终导致了神经元功能改变是ACE造成大鼠学习行为能力改变的重要原因。
炎症因子IL-1β可以反映机体炎症水平和组织的损伤程度[37]。Western Blot实验结果显示大脑皮质和海马组织中的IL-1β在ACE暴露组中均上升,抑炎因子IL-10在ACE暴露组中减少,表明新生大鼠ACE亚慢性暴露能引起中枢神经系统炎症反应。之前有研究显示[38],ACE干预可以引起体内B细胞等免疫细胞增殖下调,免疫防御作用降低,产生氧化应激反应,使免疫细胞功能下降,激活巨噬细胞转变成M1型,促进炎症因子产生。有研究明确了炎症因子对神经元的损伤作用[39],因此,ACE 40 mg·kg-1的干预引起海马和皮质组织炎症的上调,造成神经元损害,从而出现行为与认知的改变。目前研究表明,ROS在炎症反应中起到第二信使的作用,能够促进炎症反应的发生。Santhanasabapathy等[40]研究发现在大鼠脑组织中氧化应激反应的发生伴有星形胶质细胞及小胶质细胞的激活,以及促炎因子IL-lβ、TNF-a和iNOS的表达升高,同时在大脑皮层、海马及纹状体中观察到神经退行性病变的发生,也与我们的研究结果一致。氧化应激与炎症的联系最终导致了神经元功能改变是ACE造成大鼠学习行为能力改变的重要原因。
综上所述,本研究发现新生期大鼠ACE暴露9周可以导致大鼠成年后出现明显的学习记忆与认知功能减退以及海马神经元变化。氧化应激和炎症可能是ACE造成中枢神经发育毒性的机制。
[1] Bass C, Denholm I, Williamson M S, et al. The global status of insect resistance to neonicotinoid insecticides [J]. Pesticide Biochemistry and Physiology, 2015, 121: 78-87
[2] Taillebois E, Cartereau A, Jones A K, et al. Neonicotinoid insecticides mode of action on insect nicotinic acetylcholine receptors using binding studies [J]. Pesticide Biochemistry and Physiology, 2018, 151: 59-66
[![]() A, Kašuba V, Kopjar N, et al. Effects of low-level imidacloprid oral exposure on cholinesterase activity, oxidative stress responses, and primary DNA damage in the blood and brain of male Wistar rats [J]. Chemico-Biological Interactions, 2021, 338: 109287
A, Kašuba V, Kopjar N, et al. Effects of low-level imidacloprid oral exposure on cholinesterase activity, oxidative stress responses, and primary DNA damage in the blood and brain of male Wistar rats [J]. Chemico-Biological Interactions, 2021, 338: 109287
[4] Chen M, Tao L, McLean J, et al. Quantitative analysis of neonicotinoid insecticide residues in foods: Implication for dietary exposures [J]. Journal of Agricultural and Food Chemistry, 2014, 62(26): 6082-6090
[5] Menon M, Mohanraj R, Sujata W. Monitoring of neonicotinoid pesticides in water-soil systems along the agro-landscapes of the Cauvery delta region, South India [J]. Bulletin of Environmental Contamination and Toxicology, 2021, 106(6): 1065-1070
[6] Cycoń M, Piotrowska-Seget Z. Biochemical and microbial soil functioning after application of the insecticide imidacloprid [J]. Journal of Environmental Sciences, 2015, 27: 147-158
[7] Hladik M L, Kolpin D W, Kuivila K M. Widespread occurrence of neonicotinoid insecticides in streams in a high corn and soybean producing region, USA [J]. Environmental Pollution, 2014, 193: 189-196
[8] Morrissey C A, Mineau P, Devries J H, et al. Neonicotinoid contamination of global surface waters and associated risk to aquatic invertebrates: A review [J]. Environment International, 2015, 74: 291-303
[9] The Food and Agriculture Organization. 5.2 acetamiprid (246) toxicology [EB/OL]. (2019-03-28) [2022-09-14] http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Report11/Acetamiprid.pdf
[10] Zhao G P, Yang F W, Li J W, et al. Toxicities of neonicotinoid-containing pesticide mixtures on nontarget organisms [J]. Environmental Toxicology and Chemistry, 2020, 39(10): 1884-1893
[11] Wang H X, Yang D J, Fang H J, et al. Predictors, sources, and health risk of exposure to neonicotinoids in Chinese school children: A biomonitoring-based study [J]. Environment International, 2020, 143: 105918
[12] Hirai A, Sugio S, Nimako C, et al. Ca2+ imaging with two-photon microscopy to detect the disruption of brain function in mice administered neonicotinoid insecticides [J]. Scientific Reports, 2022, 12(1): 1-13
[13] Brunet J L, Maresca M, Fantini J, et al. Intestinal absorption of the acetamiprid neonicotinoid by Caco-2 cells: Transepithelial transport, cellular uptake and efflux [J]. Journal of Environmental Science and Health Part B, Pesticides, Food Contaminants, and Agricultural Wastes, 2008, 43(3): 261-270
[14] Kavvalakis M P, Tzatzarakis M N, Theodoropoulou E P, et al. Development and application of LC-APCI-MS method for biomonitoring of animal and human exposure to imidacloprid [J]. Chemosphere, 2013, 93(10): 2612-2620
[15] Todani M, Kaneko T, Hayashida H, et al. Acute poisoning with neonicotinoid insecticide acetamiprid [J]. The Japanese Journal of Toxicology, 2008, 21(4): 387-390
[16] Nakayama A, Yoshida M, Kagawa N, et al. The neonicotinoids acetamiprid and imidacloprid impair neurogenesis and alter the microglial profile in the hippocampal dentate gyrus of mouse neonates [J]. Journal of Applied Toxicology, 2019, 39(6): 877-887
[17] EFSA Panel on Plant Protection Products and their Residues (PPR). Scientific Opinion on the developmental neurotoxicity potential of acetamiprid and imidacloprid [J]. EFSA Journal, 2013, 11(12): 3471
[18] Simon-Delso N, Amaral-Rogers V, Belzunces L P, et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites [J]. Environmental Science and Pollution Research, 2015, 22(1): 5-34
[19] Aseperi A K, Busquets R, Hooda P S, et al. Behaviour of neonicotinoids in contrasting soils [J]. Journal of Environmental Management, 2020, 276: 111329
[20] Loser D, Hinojosa M G, Blum J, et al. Functional alterations by a subgroup of neonicotinoid pesticides in human dopaminergic neurons [J]. Archives of Toxicology, 2021, 95(6): 2081-2107
[21] Gasmi S, Kebieche M, Rouabhi R, et al. Alteration of membrane integrity and respiratory function of brain mitochondria in the rats chronically exposed to a low dose of acetamiprid [J]. Environmental Science and Pollution Research, 2017, 24(28): 22258-22264
[22] Karaca B U, Arican Y E, Boran T, et al. Toxic effects of subchronic oral acetamiprid exposure in rats [J]. Toxicology and Industrial Health, 2019, 35(11-12): 679-687
[23] Kagawa N, Nagao T. Neurodevelopmental toxicity in the mouse neocortex following prenatal exposure to acetamiprid [J]. Journal of Applied Toxicology, 2018, 38(12): 1521-1528
[24] Dhouib I B, Annabi A, Doghri R, et al. Neuroprotective effects of curcumin against acetamiprid-induced neurotoxicity and oxidative stress in the developing male rat cerebellum: Biochemical, histological, and behavioral changes [J]. Environmental Science and Pollution Research International, 2017, 24(35): 27515-27524
[25] Shamsi M, Soodi M, Shahbazi S, et al. Effect of acetamiprid on spatial memory and hippocampal glutamatergic system [J]. Environmental Science and Pollution Research International, 2021, 28(22): 27933-27941
[26] 胡爱萍, 周红宇, 秦晓怡. 甲醛对小鼠的学习记忆及脑组织抗氧化酶的影响[J]. 环境与健康杂志, 2007, 24(9): 686-688
Hu A P, Zhou H Y, Qin X Y. Effects of formaldehyde on learning, memory and activity of antioxidase in cerebral tissues of mice [J]. Journal of Environment and Health, 2007, 24(9): 686-688 (in Chinese)
[27] Mandal P, Mondal S, Karnam S S, et al. A behavioral study on learning and memory in adult Sprague Dawley rat in induced acetamiprid toxicity [J]. Exploratory Animal and Medical Research, 2015, 5: 27-32
[28] Ford K A, Casida J E. Chloropyridinyl neonicotinoid insecticides: Diverse molecular substituents contribute to facile metabolism in mice [J]. Chemical Research in Toxicology, 2006, 19(7): 944-951
[29] Abd-Elhakim Y M, Mohammed H H, Mohamed W A M. Imidacloprid impacts on neurobehavioral performance, oxidative stress, and apoptotic events in the brain of adolescent and adult rats [J]. Journal of Agricultural and Food Chemistry, 2018, 66(51): 13513-13524
[30] Bhardwaj S, Srivastava M K, Kapoor U, et al. A 90 days oral toxicity of imidacloprid in female rats: Morphological, biochemical and histopathological evaluations [J]. Food and Chemical Toxicology, 2010, 48(5): 1185-1190
[31] Agrawal A, Sharma B. Pesticides induced oxidative stress in mammalian systems: A review [J]. International Journal of Biological &Medical Research, 2010, 1(3): 90-104
[32] Salim S. Oxidative stress and the central nervous system [J]. Journal of Pharmacology and Experimental Therapeutics, 2016, 360(1): 201-205
[33] Annabi E, Ben Salem I, Abid-Essefi S. Acetamiprid, a neonicotinoid insecticide, induced cytotoxicity and genotoxicity in PC12 cells [J]. Toxicology Mechanisms and Methods, 2019, 29(8): 580-586
[34] Panemangalore M, Bebe F N. Dermal exposure to pesticides modifies antioxidant enzymes in tissues of rats [J]. Journal of Environmental Science and Health, Part B, 2000, 35(4): 399-416
[35] Terayama H, Endo H, Tsukamoto H, et al. Acetamiprid accumulates in different amounts in murine brain regions [J]. International Journal of Environmental Research and Public Health, 2016, 13(10): 937
[36] Taylor J M, Main B S, Crack P J. Neuroinflammation and oxidative stress: Co-conspirators in the pathology of Parkinson’s disease [J]. Neurochemistry International, 2013, 62(5): 803-819
[37] Lopez-Rodriguez A B, Hennessy E, Murray C L, et al. Acute systemic inflammation exacerbates neuroinflammation in Alzheimer’s disease: IL-1β drives amplified responses in primed astrocytes and neuronal network dysfunction [J]. Alzheimer’s &Dementia, 2021, 17(10): 1735-1755
[38] Lee G H, Choi K C. Adverse effects of pesticides on the functions of immune system [J]. Comparative Biochemistry and Physiology Part C: Toxicology &Pharmacology, 2020, 235: 108789
[39] Mendiola A S, Cardona A E. The IL-1β phenomena in neuroinflammatory diseases [J]. Journal of Neural Transmission, 2018, 125(5): 781-795
[40] Santhanasabapathy R, Vasudevan S, Anupriya K, et al. Farnesol quells oxidative stress, reactive gliosis and inflammation during acrylamide-induced neurotoxicity: Behavioral and biochemical evidence [J]. Neuroscience, 2015, 308: 212-227