抗生素是一类具有抵抗微生物活性的天然、半天然合成或人工合成的化合物,被广泛应用于疾病治疗、农业生产、畜牧以及水产养殖当中。我国是抗生素的生产和使用大国,医用和畜牧业抗生素滥用情况比较严重,2013年中国抗生素使用量约为16.2万t,是欧洲和美国的6倍[1]。抗生素的半衰期虽然较其他持久性有机污染物短,但是由于大量使用加之其进入生物体内后未能被使用或代谢完全,导致30%~90%的抗生素以原药的形式被生物体排出体外,从而在水环境中呈现一种“假持久性”[2-3]。同时,环境中残留的抗生素通过吸附、迁移和生物富集等途径在水、沉积物以及水生生物中累积,对水生态系统造成潜在风险[4]。此外环境中的抗生素还可能通过饮用水和食物网在人体中累积,使人体产生耐药性基因,造成损伤和过敏反应[5-6]。
目前在全球范围内,地表水、地下水甚至是饮用水中均能够检测到抗生素的存在,其污染浓度范围多在ng·L-1至μg·L-1间。不同研究中暴露出的水环境中残留抗生素的潜在生态风险已受到全球环境学者的广泛关注[7-8]。因此,分析不通流域抗生素在地表水中的污染水平并评价其潜在环境风险是认识其环境归趋的重要前提。磺胺类药物(sulfonamides, SAs)是历史上使用时间最长的合成抗生素,具有化学结构稳定、价格低廉和抗菌效果广谱等特点,是近年来农业和畜牧养殖业最常用的抗生素之一[9]。大环内酯类药物(macrolides, MLs)作为一种广谱抗生素,被广泛应用于人和动物呼吸道、胃肠道感染等疾病的预防和治疗,且近年来,对遏制细菌耐药性、增强抗菌作用等研究已成大环内酯类抗生素的主体研发方向[10]。本文主要选取磺胺及大环内酯类抗生素在成都市流域地表水中的残留及生态风险进行研究。
近年来,人们对于抗生素等新型有机污染物的关注程度也在提高。在川渝地区,王若男等[11]对沱江干流7个大类35种抗生素进行时空变化分析以及风险评估;严清等[12]对重庆主城区水域典型医药活性物质(PhACs)污染水平及生态风险进行评估;巫明毫等[13]对四川典型湖泊/水库进行抗生素残留特征以及风险评估等。成都作为我国西南地区发展最快的城市之一,人口密度大,经济发达,相对应的抗生素的使用量也十分巨大[14];由于大多数污水厂现有工艺无法去除污水中的抗生素,导致各类抗生素的进入水体的风险变大,值得重视。但目前关于成都市地表水中的抗生素时空分布及生态风险评价还鲜有报道。因此,基于对成都市地表水的基本特征,分别选取受人类活动、畜禽养殖和农业面源污染影响较大的蒲江河、锦江、西江河、毗河和濛阳河等5个小流域为研究对象,分析了这几个流域地表水中16种磺胺及8种大环内酯共24种抗生素的时空分布,并通过风险商值法(RQs),对部分磺胺类、大环内酯类抗生素生态风险进行分析,初步掌握磺胺及大环内酯类抗生素在成都市地表水环境中的污染现状及其生态风险强度,为下一步成都市抗生素管理控制、污染防治工作提供支撑[4]。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
TSQ Quantum Access MAX液质联用仪(ESI源,Thermo,美国)、色谱柱(Syncronis C18 100 mm×2.1 mm×1.7 μm)(Thermo,美国)、萃取装置(Vac Elut SPS 24,Agilent,美国) HLB固相萃取小柱(6 mL,500 mg)(Waters,美国)、浓缩仪(Turbo VapⅡ,Biotage)、混合纤维滤膜(0.45 μm,47 mm,上海安谱,中国)。
磺胺类药物(SAs):磺胺醋酰(sulfacetamide, SA)、磺胺氯哒嗪(sulfachloropyridazine, SCP)、磺胺嘧啶(sulfadiazine, SDZ)、磺胺多辛(sulfadoxine, SDX)、磺胺间二甲氧嘧啶(sulfadimethoxypyrimidine, SDM)、磺胺甲基嘧啶(sulfamerazine, SMR)、磺胺对甲氧嘧啶(sulfameter, SFM)、磺胺二甲嘧啶(sulfamethazine, SMZ)、磺胺甲噻二唑(sulfamethizole, SMTZ)、磺胺甲恶唑(sulfamethoxazole, SMX)、磺胺乙氧嗪(sulfamethoxypyridazine, SMP)、磺胺甲氧嘧啶(sulfamonomethoxine, SMM)、磺胺苯吡唑(sulfaphenazole, SPZ)、磺胺吡啶(sulfapyridine, SPD)、磺胺噻唑(sulfathiazole, STZ)和磺胺异恶唑(sulfisoxazole, SSZ)。大环内酯类(MLs):阿奇霉素(azithromycin, AZM)、克拉霉素(clarithromycin, CTM)、红霉素(erythromycin, ETM)、交沙霉素(josamycin, JSM)、白霉素(leucomycin, LM)、螺旋霉素(spiramycin, SPM)、替米考星(tilmicosin, TIL)、泰乐菌素(tylosin, TYL)及其内标物磺胺嘧啶-d4(sulfadiazine-d4, SDZ-d4)、罗红霉-d5((roxithromycin-d5, RTM-d5)。以上标准品试剂均购自于德国Dr. Ehrenstorfer GmbH公司,纯度>98%。甲醇、甲酸为色谱纯(Thermo,美国),乙二胺四乙酸二钠盐(Na2EDTA·2H2O)购自上海安谱实验科技有限公司(中国),所有抗生素标准品均用甲醇稀释定容,置于-20 ℃低温冰箱中避光保存。
1.2 样品采集
选取的采样点位于成都市蒲江河(S1~S6)、锦江(S7~S11)、西江河(S12~S17)、毗河(S18~S23)和濛阳河(S24~S31)5个小流域,分别代表了受人类活动、畜禽养殖、农业面源污染影响较大的流域,代表了成都市的典型污染源类别。在这5个流域共设置了采样点31个(图1),采样时间分别在2021年3月(枯水期)2021年8月(丰水期),每个点位采集一个平行样。用不锈钢采样器采集表层水样(0~0.5 m深),装入避光的1 L棕色玻璃采样瓶中。所有样品采集后低温保存,运回实验室48 h内完成预处理。
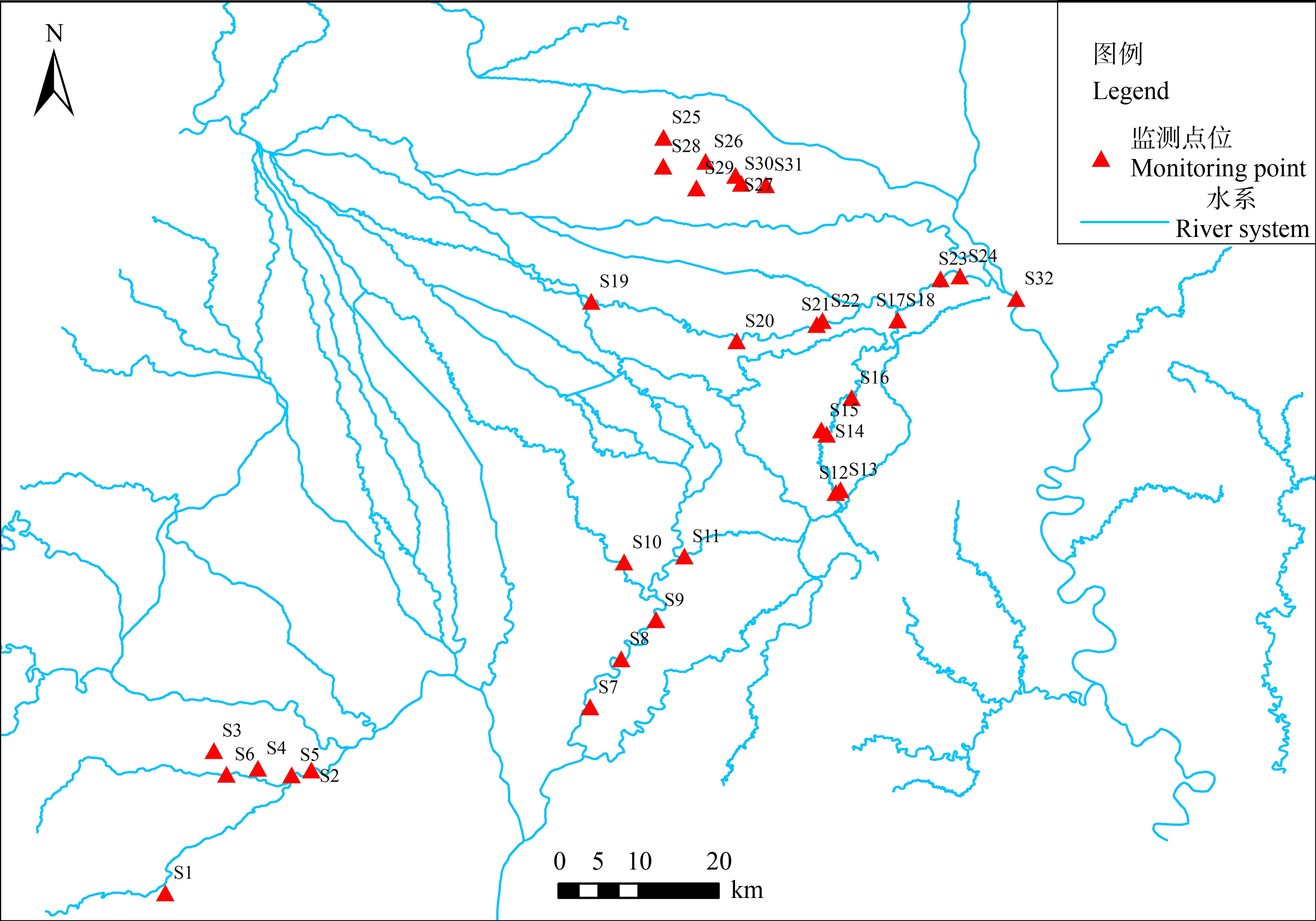
图1 采样点位分布图
Fig. 1 Distribution of sampling points
1.3 样品预处理
用0.45 μm混合纤维滤膜抽滤1 L水样后,加入0.025 g Na2EDTA。利用Vac Elut SPS 24真空萃取装置对样品进行富集。先后用10 mL甲醇、10 mL超纯水分2次预淋洗活化HLB小柱,使用抽滤装置控制流速,保持速度在2~3 滴·s-1,直至水样完全通过HLB柱。萃取结束后,使用抽滤装置继续将HLB柱抽至完全全干燥,后用10 mL甲醇对HLB柱进行洗脱,收集洗脱液于试管中,在30 ℃下将洗脱液氮吹至0.5 mL,再用甲醇定容至1 mL,于-20 ℃低温冰箱保存待测。
1.4 仪器分析
仪器采用美国Thermo公司生产的TSQ Quantum Access MAX三重四级杆液质联用仪(分离采用Syncronis C18 100 mm×2.1 mm×1.7 μm色谱分析柱)进行分析测试。流动相A相为0.1%的甲酸溶液,B相为纯甲醇,流速为0.25 mL·min-1;进样体积5 μL,柱温40 ℃。采用梯度洗脱进行分离,洗脱程序如下:0~1.5 min,20% B;1.5~4.5 min,95% B;4.5~7 min,95% B;7~7.5 min,20% B;7.5~10 min,20% B。电离源采用电喷雾(ESI)离子源正离子模式扫描,多反应离子(MRM)扫描目标化合物。电离电压3 500 V;鞘气压力49 kPa;辅助气压力5 kPa;离子源温度350 ℃。目标化合物信息以及质谱参数见表1。
表1 目标化合物的质谱优化参数
Table 1 Optimized parameters of target compounds by mass spectrometry
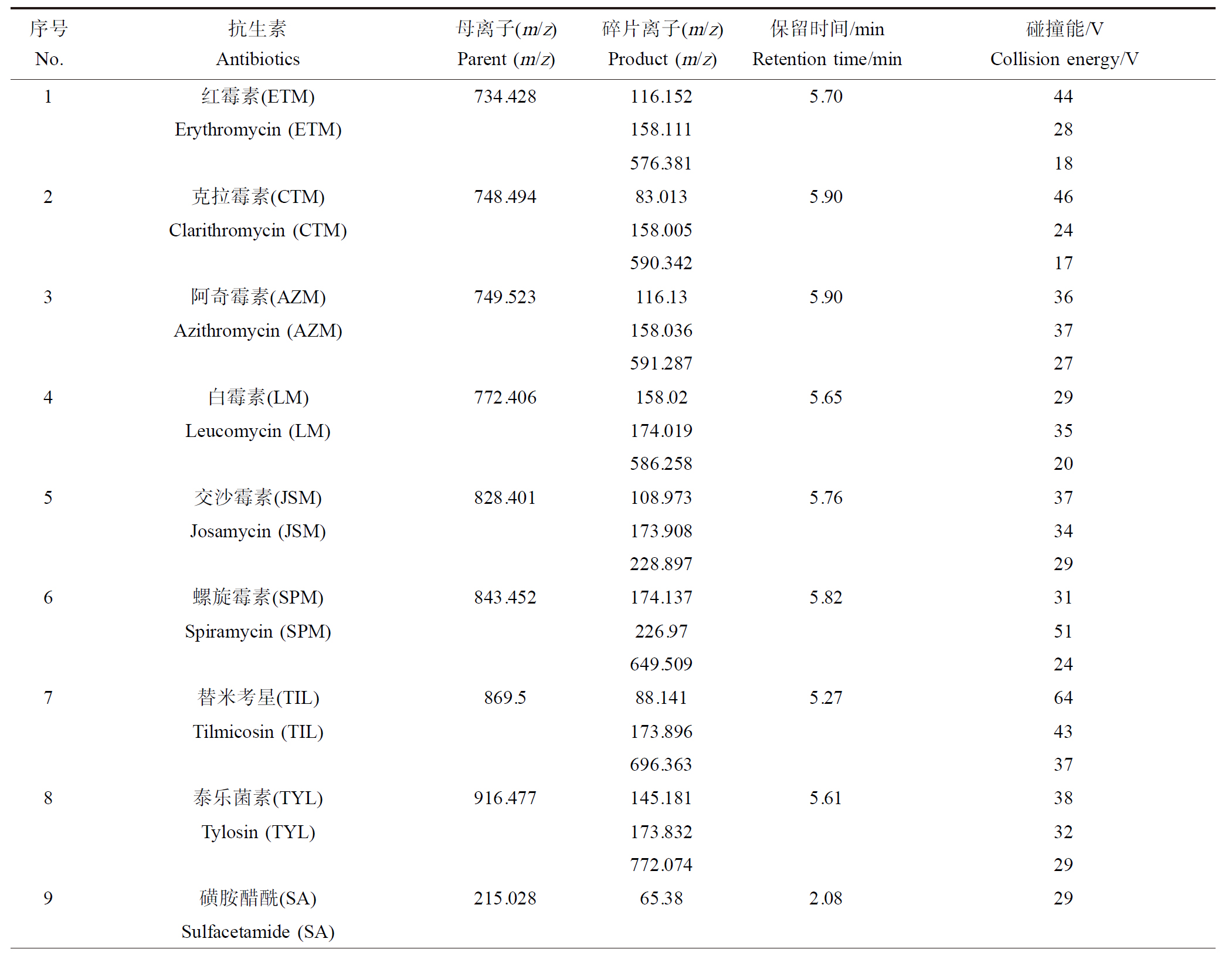
序号No.抗生素Antibiotics母离子(m/z)Parent (m/z)碎片离子(m/z)Product (m/z)保留时间/minRetention time/min碰撞能/VCollision energy/V1红霉素(ETM)734.428116.1525.7044Erythromycin (ETM)158.11128576.381182克拉霉素(CTM)748.49483.0135.9046Clarithromycin (CTM)158.00524590.342173阿奇霉素(AZM)749.523116.135.9036Azithromycin (AZM)158.03637591.287274白霉素(LM)772.406158.025.6529Leucomycin (LM)174.01935586.258205交沙霉素(JSM)828.401108.9735.7637Josamycin (JSM)173.90834228.897296螺旋霉素(SPM)843.452174.1375.8231Spiramycin (SPM)226.9751649.509247替米考星(TIL)869.588.1415.2764Tilmicosin (TIL)173.89643696.363378泰乐菌素(TYL)916.477145.1815.6138Tylosin (TYL)173.83232772.074299磺胺醋酰(SA)215.02865.382.0829Sulfacetamide (SA)10磺胺吡啶(SPD)250.01292.0763.1126Sulfapyridine (SPD)108.11624155.9791711磺胺嘧啶(SDZ)251.02392.12.4929Sulfadiazine (SDZ)108.0534156.021712磺胺甲恶唑(SMX)254.00792.1045.8925Sulfamethoxazole (SMX)107.88822155.9551613磺胺噻唑(STZ)256.00192.1142.7330Sulfathiazole (STZ)156.01113224.1781814磺胺甲基嘧啶(SMR)265.06591.9033.7031Sulfamerazine (SMR)108.08424155.8321215磺胺异恶唑(SSZ)268.02392.0616.1726Sulfisoxazole (SSZ)107.94828155.991016磺胺甲噻二唑(SMTZ)271.00592.1775.0531Sulfamethizole (SMTZ)108.11925156.0061517磺胺二甲嘧啶(SMZ)279.03292.1785.2134
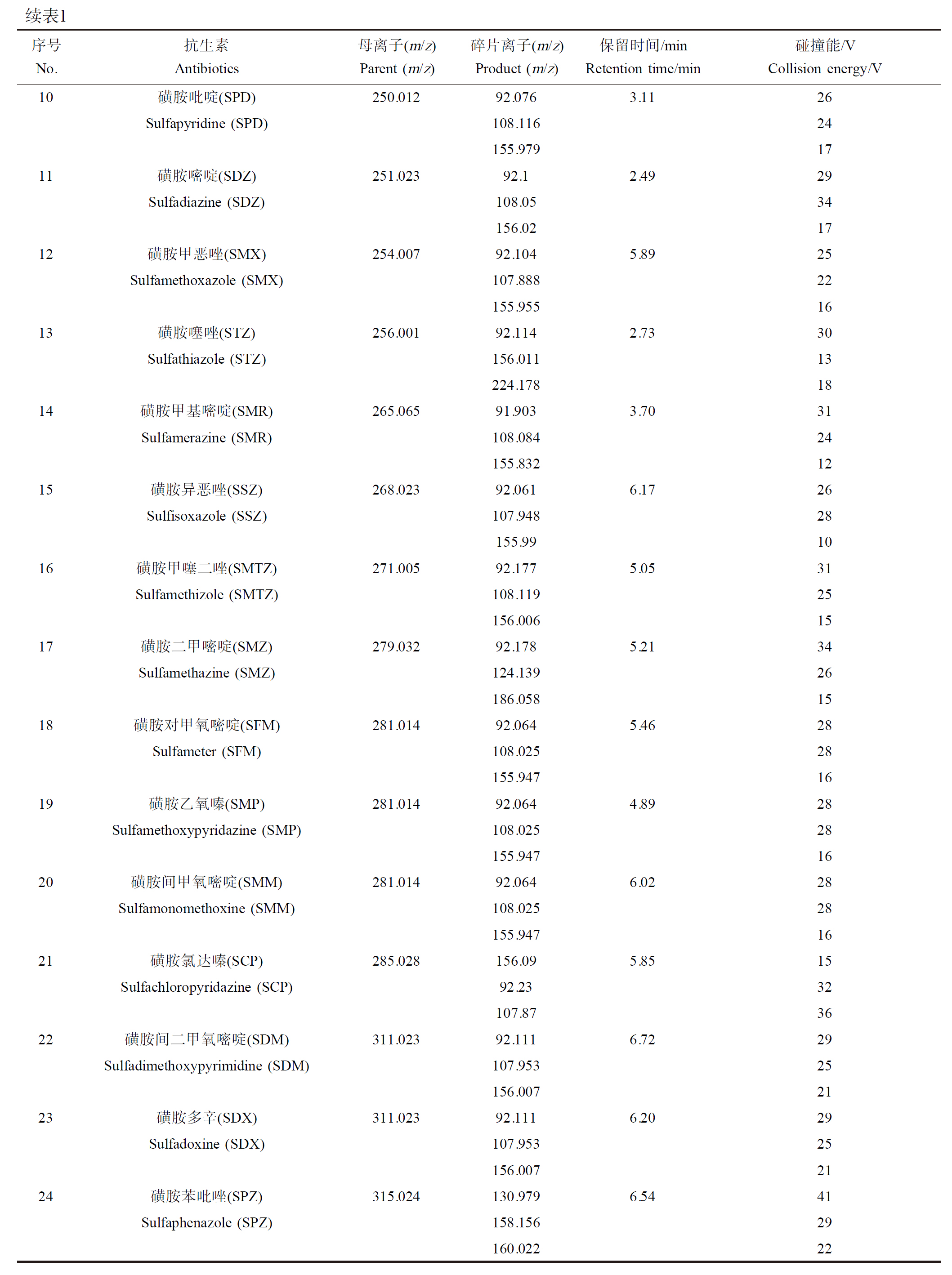
续表1序号No.抗生素Antibiotics母离子(m/z)Parent (m/z)碎片离子(m/z)Product (m/z)保留时间/minRetention time/min碰撞能/VCollision energy/VSulfamethazine (SMZ)124.13926186.0581518磺胺对甲氧嘧啶(SFM)281.01492.0645.4628Sulfameter (SFM)108.02528155.9471619磺胺乙氧嗪(SMP)281.01492.0644.8928Sulfamethoxypyridazine (SMP)108.02528155.9471620磺胺间甲氧嘧啶(SMM)281.01492.0646.0228Sulfamonomethoxine (SMM)108.02528155.9471621磺胺氯达嗪(SCP)285.028156.095.8515Sulfachloropyridazine (SCP)92.2332107.873622磺胺间二甲氧嘧啶(SDM)311.02392.1116.7229Sulfadimethoxypyrimidine (SDM)107.95325156.0072123磺胺多辛(SDX)311.02392.1116.2029Sulfadoxine (SDX)107.95325156.0072124磺胺苯吡唑(SPZ)315.024130.9796.5441Sulfaphenazole (SPZ)158.15629160.02222
1.5 质量控制
采用内标法定量分析。配制0、1、10、20、50、100、200和400 μg·L-1的24种抗生素混合标准溶液,选用SMX-d4和RTM-d7作为目标分析物的内标,内标的浓度为50 μg·L-1。每间隔12个样品检测浓度为100 μg·L-1的标准溶液,以监测仪器测试系统性能及测量误差;其相关系数(r2)均>0.99,分别以S/N≥3和S/N≥10的信噪比计算方法检出限及定量限,分别为0.004~0.928 ng·L-1和0.014~3.096 ng·L-1。取与待测水样相同体积的超纯水做加标回收,加入浓度分别为50 μg·L-1和100 μg·L-1,设置3次平行,回收率结果显示,磺胺类化合物的测定回收率为68.98%~109.44%,相对标准偏差为0.27%~12.31%;大环内酯类化合物的测定回收率为84.8%~113.0%,相对标准偏差为2.3%~12.7%。
2 结果与讨论(Results and discussion)
2.1 研究区域抗生素的总体特征
24种抗生素丰水期和枯水期检出率分布情况如图2所示。结果表明,所研究的16种磺胺及8种大环内酯类抗生素在成都市蒲江河流域、毗河流域、西江河流域、濛阳河流域和锦江流域均有所检出,仅LM在丰水期未检出。总体而言,不同抗生素的检出率范围在38.71%~100%之间,平均检出率为85.88%,磺胺类抗生素整体检出率(89.71%)高于大环内酯(78.22%)。抗生素检出浓度范围为0.01~3 249 ng·L-1。检出率如图2所示,磺胺类中SMX和SMM检出率最高,均为100%;大环内酯中JSM和TIL检出率最高,分别为88.7%和87.0%。
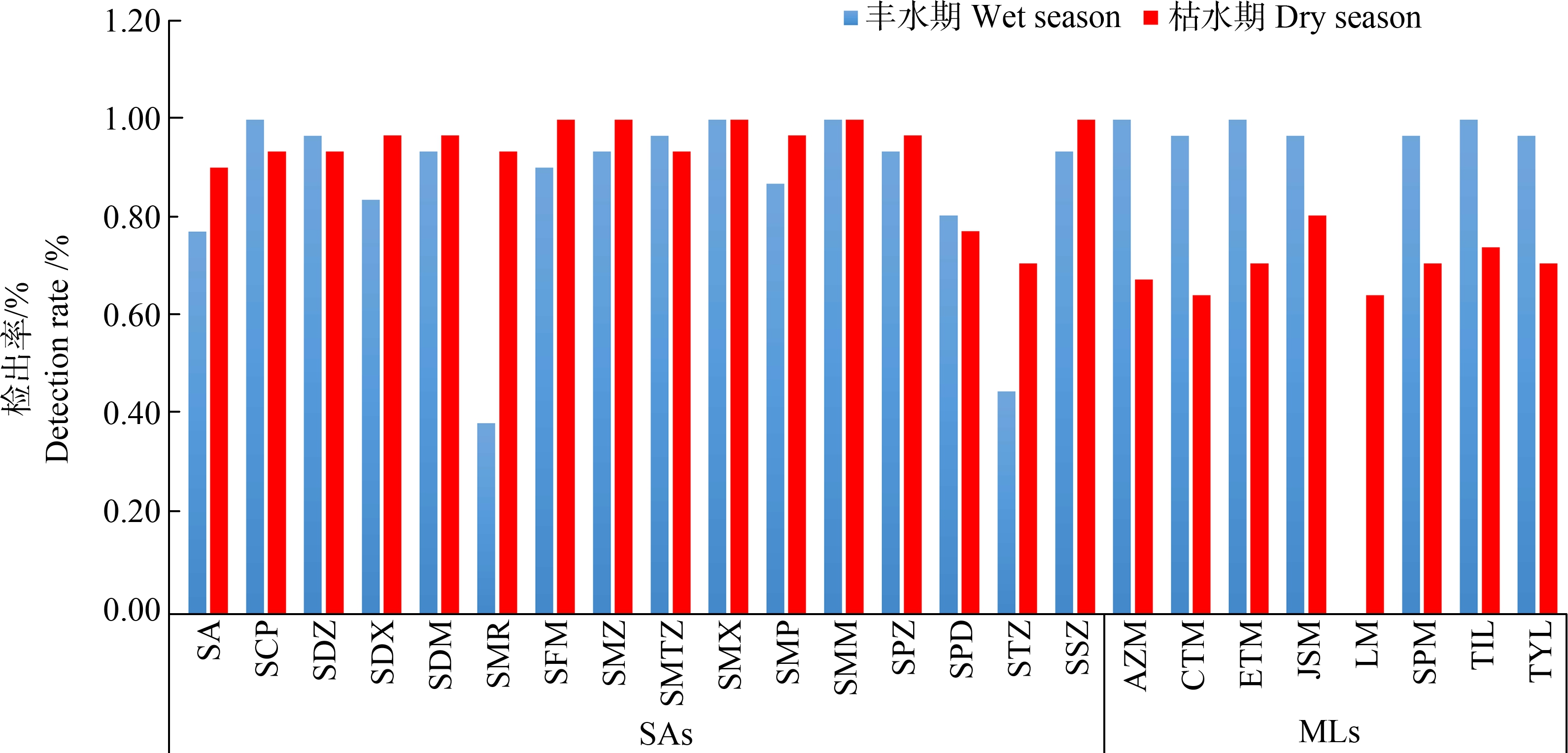
图2 各类抗生素丰水期和枯水期检出率
Fig. 2 Detection rates of antibiotics in wet season and dry season
24种抗生素在丰水期和枯水期的检出浓度水平以及浓度分布如表2和图3所示。结合表2和图3分析得出,24种抗生素检出的浓度介于0.01~3 249 ng·L-1之间,平均浓度25.91 ng·L-1。24种抗生素中,大环内酯类ETM检出浓度最高且遍布31个点位,浓度范围介于14.36~1 754 ng·L-1之间,平均浓度495.3 ng·L-1,其次是AZM,浓度范围为1.19~73.82 ng·L-1,平均浓度40.21 ng·L-1,2个水期中检出浓度最高的抗生素均为ETM,分别为3.25 μg·L-1(枯水期)和1.75 μg·L-1(丰水期),由此分析ETM可能为成都市地表水流域中最主要的抗生素类别。磺胺类抗生素中,检出浓度最大的几种抗生素分别是SMM、SMZ和SMX,平均浓度22.17、7.86和8.15 ng·L-1,其中SMX是由美国食品及药物管理局规定的需要优先被检测的14种磺胺类药物中的一种[15-16],且在我国其他城市地表水环境中也有相关的检出报道[17-18]。磺胺和大环内酯类抗生素在成都市地表水环境中检出浓度及检出率均比较高,这与我国其他水域检出结果基本一致,例如陈欣仪等[19]对南方某河流型地表水中6种大环内酯和磺胺的检出浓度为2.00~1 428 ng·L-1;金磊等[17]对华东地区水源水中13种磺胺类抗生素的检出浓度为10.5~238.5 ng·L-1。这种检出率及检出浓度较高的现象,一方面反映了成都市对于磺胺和大环内酯类抗生素的使用较为频繁,另外一方面与抗生素本身性质相关,磺胺自身具有良好的环境迁移能力以及化学稳定性,不易发生吸附和降解;而大环内酯常用于人类和动物的疾病治疗,化学性质同样比较稳定,不容易被降解去除,因此导致磺胺和大环内酯类抗生素检出浓度偏高[20-21]。
表2 研究区内抗生素的浓度水平
Table 2 Overall detection level of antibiotics in the study area (ng·L-1)
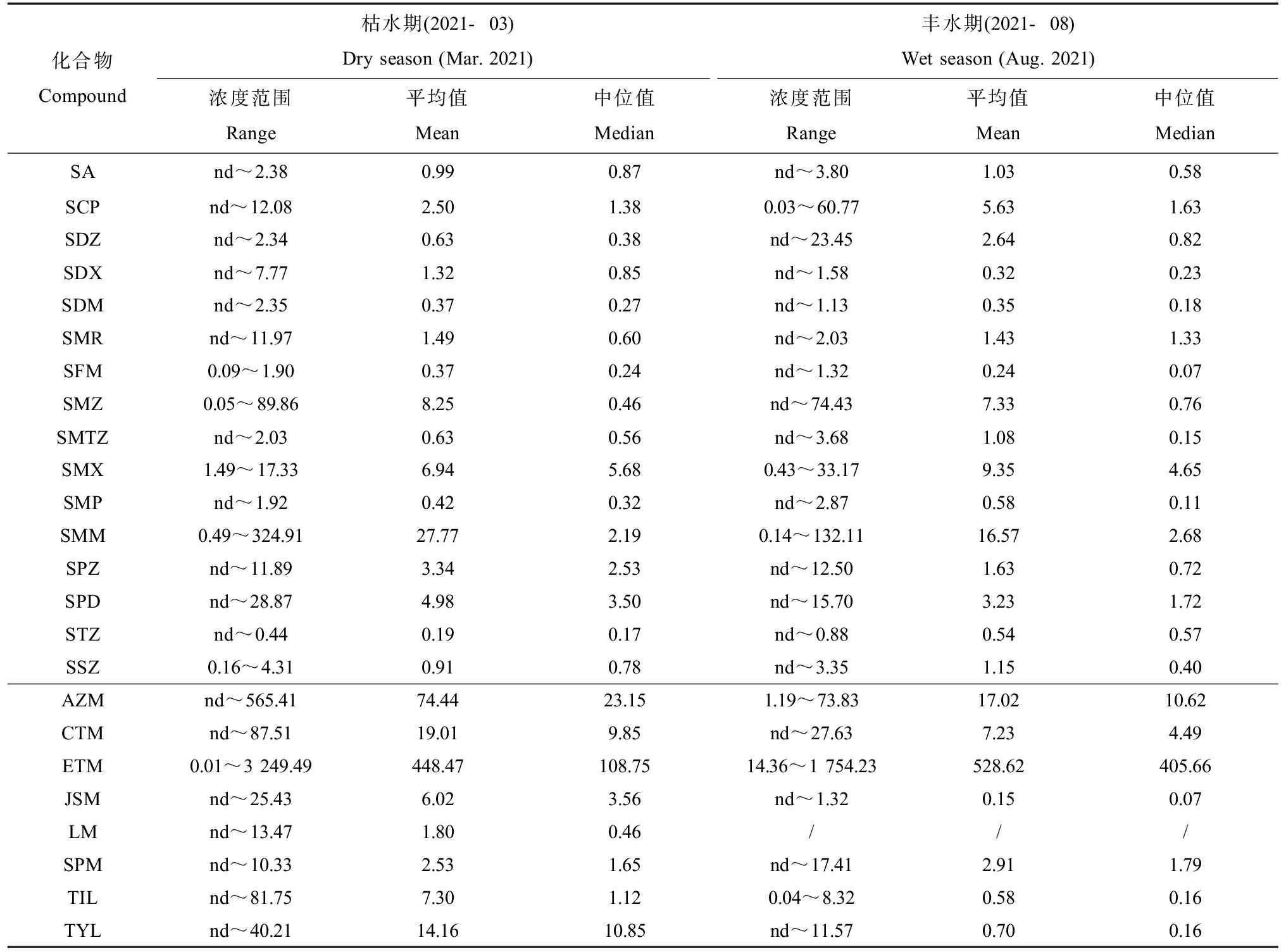
化合物Compound枯水期(2021-03)Dry season (Mar. 2021)丰水期(2021-08)Wet season (Aug. 2021)浓度范围Range平均值Mean中位值Median浓度范围Range平均值Mean中位值MedianSAnd~2.380.99 0.87 nd~3.801.03 0.58 SCPnd~12.082.50 1.38 0.03~60.775.63 1.63 SDZnd~2.340.63 0.38 nd~23.452.64 0.82 SDXnd~7.771.32 0.85 nd~1.580.32 0.23 SDMnd~2.350.37 0.27 nd~1.130.35 0.18 SMRnd~11.971.49 0.60 nd~2.031.43 1.33 SFM0.09~1.900.37 0.24 nd~1.320.24 0.07 SMZ0.05~89.868.25 0.46 nd~74.437.33 0.76 SMTZnd~2.030.63 0.56 nd~3.681.08 0.15 SMX1.49~17.336.94 5.68 0.43~33.179.35 4.65 SMPnd~1.920.42 0.32 nd~2.870.58 0.11 SMM0.49~324.9127.77 2.19 0.14~132.1116.57 2.68 SPZnd~11.893.34 2.53 nd~12.501.63 0.72 SPDnd~28.874.98 3.50 nd~15.703.23 1.72 STZnd~0.440.19 0.17 nd~0.880.54 0.57 SSZ0.16~4.310.91 0.78 nd~3.351.15 0.40 AZMnd~565.4174.44 23.15 1.19~73.8317.02 10.62 CTMnd~87.5119.01 9.85 nd~27.637.23 4.49 ETM0.01~3 249.49448.47 108.75 14.36~1 754.23528.62 405.66 JSMnd~25.436.02 3.56 nd~1.320.15 0.07 LMnd~13.471.80 0.46 ///SPMnd~10.332.53 1.65 nd~17.412.91 1.79 TILnd~81.757.30 1.12 0.04~8.320.58 0.16 TYLnd~40.2114.16 10.85 nd~11.570.70 0.16

图3 抗生素丰水期和枯水期浓度分布图
Fig. 3 Concentration distribution of antibiotics in wet season and dry season
2.2 抗生素的时间分布特征
由图4可知,结合t检验结果(表3)可以看出,抗生素整体浓度丰水期大于枯水期(P<0.05),丰水期和枯水期平均浓度分别为29.49 ng·L-1和22.45 ng·L-1。在研究流域中,大部分的磺胺类化合物在枯水期和丰水期的浓度变化规律不明显,但少部分抗生素如SMM、SMX和SSZ等丰水期检出浓度略高于枯水期,推测可能受降雨及污染排放影响。大环内酯类抗生素丰水期大部分化合物检出浓度远高于枯水期,如AZM、CTM和ETM等抗生素,其中ETM在2个水期均表现出较高的检出浓度,可能与抗生素本身特性及周边污水排放有关。水环境中抗生素的残留主要受多方面因素影响,如人类活动、降雨量、季节温度变化、光解作用以及微生物代谢等多方面因素,丰水期正处于夏秋季节,人类活动、农业种植和畜禽养殖比较频繁,抗生素使用量较大,污水排放中的抗生素浓度可能会偏高。此外,丰水期的较强降雨会将使用后残留在土壤等环境中的抗生素通过地表径流的形式汇集到流域中,同时原来吸附于沉积物中的抗生素也可能会因河水扰动重新回到上层水中[22]。在枯水期降雨减少,地表难以形成有效径流,其余各支流水量锐减甚至部分支流断流,可能使得抗生素来源途径减少,使得丰水期抗生素残留浓度高于枯水期[21]。
表3 丰、枯水期地表水中抗生素质量浓度的配对样本t检验
Table 3 Paired samplef-test for the mass concentration of antibiotics in surface water during wet and dry seasons
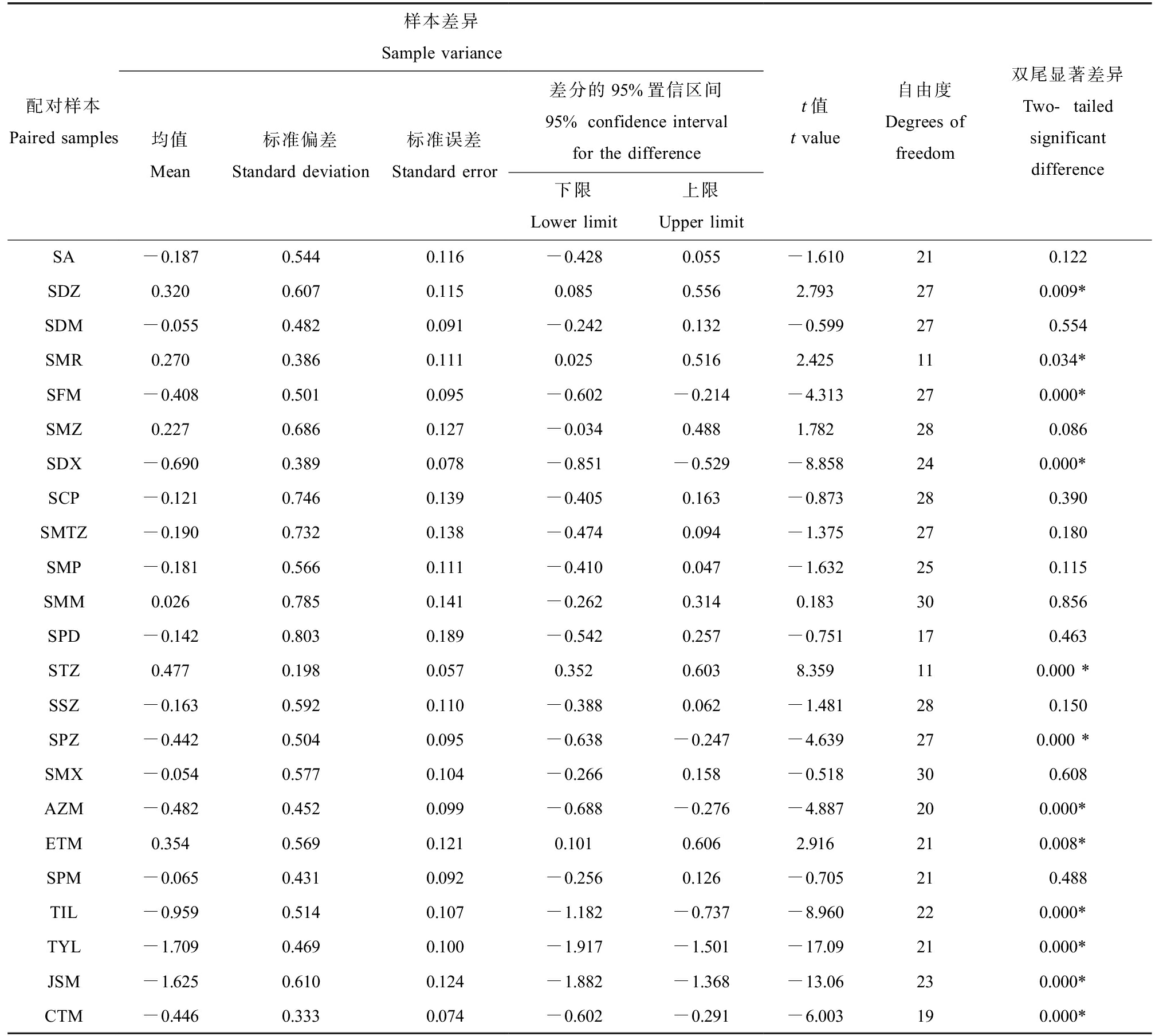
配对样本Paired samples样本差异Sample variance均值Mean标准偏差Standard deviation标准误差Standard error差分的95%置信区间95% confidence interval for the difference下限Lower limit上限Upper limitt值t value自由度Degrees of freedom双尾显著差异Two-tailed significant differenceSA-0.187 0.544 0.116 -0.428 0.055 -1.610 210.122 SDZ0.320 0.607 0.115 0.085 0.556 2.793 270.009*SDM-0.055 0.482 0.091 -0.242 0.132 -0.599 270.554 SMR0.270 0.386 0.111 0.025 0.516 2.425 110.034*SFM-0.408 0.501 0.095 -0.602 -0.214 -4.313 270.000*SMZ0.227 0.686 0.127 -0.034 0.488 1.782 280.086 SDX-0.690 0.389 0.078 -0.851 -0.529 -8.858 240.000*SCP-0.121 0.746 0.139 -0.405 0.163 -0.873 280.390 SMTZ-0.190 0.732 0.138 -0.474 0.094 -1.375 270.180 SMP-0.181 0.566 0.111 -0.410 0.047 -1.632 250.115 SMM0.026 0.785 0.141 -0.262 0.314 0.183 300.856 SPD-0.142 0.803 0.189 -0.542 0.257 -0.751 170.463 STZ0.477 0.198 0.057 0.352 0.603 8.359 110.000 *SSZ-0.163 0.592 0.110 -0.388 0.062 -1.481 280.150 SPZ-0.442 0.504 0.095 -0.638 -0.247 -4.639 270.000 *SMX-0.054 0.577 0.104 -0.266 0.158 -0.518 300.608 AZM-0.482 0.452 0.099 -0.688 -0.276 -4.887 200.000*ETM0.354 0.569 0.121 0.101 0.606 2.916 210.008*SPM-0.065 0.431 0.092 -0.256 0.126 -0.705 210.488 TIL-0.959 0.514 0.107 -1.182 -0.737 -8.960 220.000*TYL-1.709 0.469 0.100 -1.917 -1.501 -17.09 210.000*JSM-1.625 0.610 0.124 -1.882 -1.368 -13.06 230.000*CTM-0.446 0.333 0.074 -0.602 -0.291 -6.003 190.000*
注:*表示差异性显著(P<0.05)。
Note: *indicates significant difference (P<0.05).
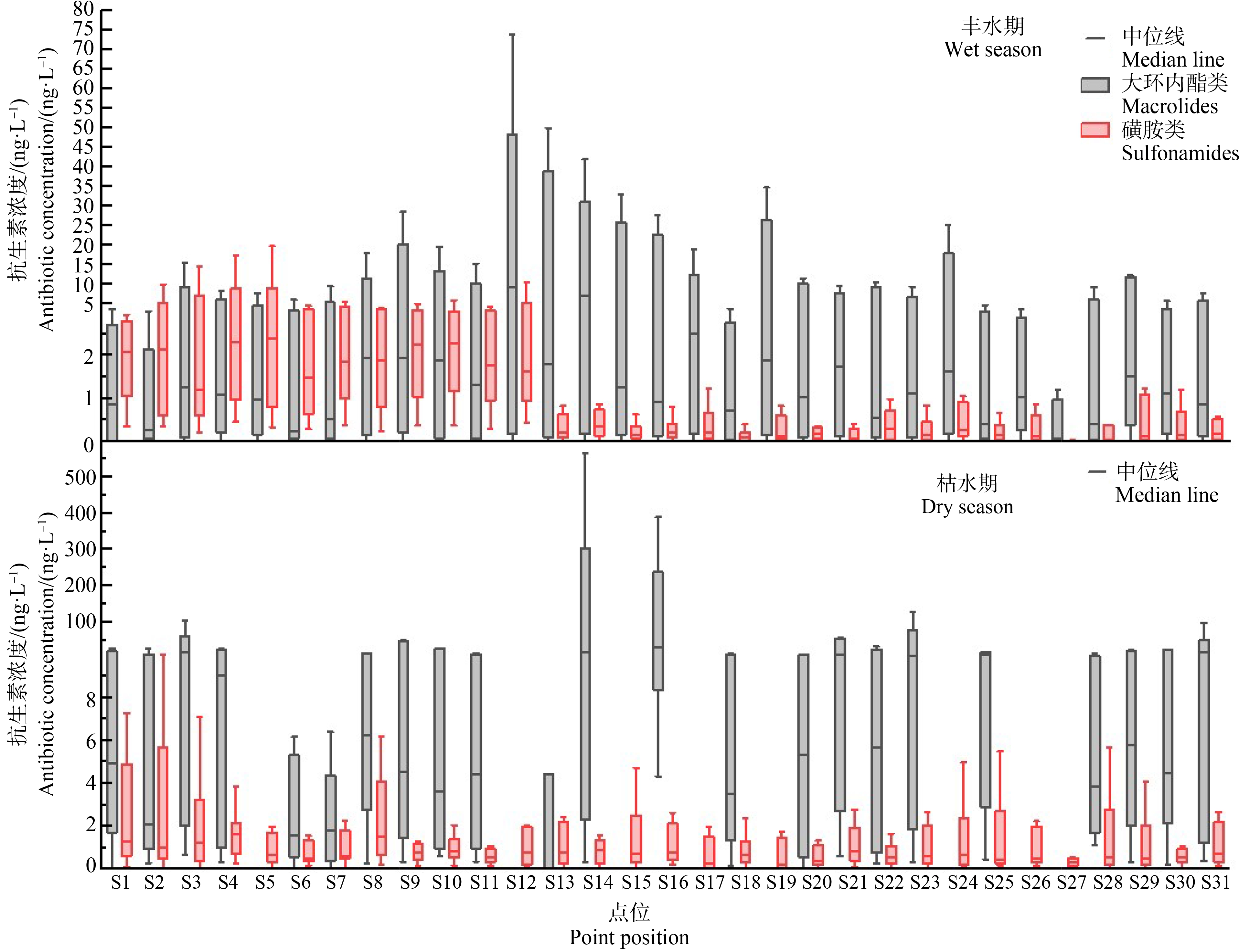
图4 抗生素累积浓度分布图
Fig. 4 Cumulative concentration distribution of antibiotics
2.3 抗生素空间分布特征
磺胺类和大环内酯类抗生素在成都市5条流域检出范围如表4所示,丰水期和枯水期浓度范围分别为0.02~1 754 ng·L-1和0.01~3 249 ng·L-1。检出浓度最高的是西江河流域0.04~3 249 ng·L-1,其次为锦江流域0.05~1 029 ng·L-1、毗河流域0.02~987.4 ng·L-1以及蒲江河流域0.03~802.7 ng·L-1;濛阳河抗生素检出浓度最低,为0.01~506.0 ng·L-1。与国内其他地区相比,研究流域磺胺类抗生素浓度水平与崇明地区(nd~305.5 ng·L-1)地表水中磺胺类抗生素浓度相当[23],低于珠江(34~859 ng·L-1)[24],高于钦州湾河流(0.94~14 ng·L-1)[25]和渭河西安段(0.56~178.4 ng·L-1)等地表水[26];大环内酯检出浓度则远高于国内苏州市(nd~22.7 ng·L-1)[27]、江汉平原(6.7~381.6 ng·L-1)[28]等地区地表水。由图3可知,2个水期中绝大部分的污染浓度来自于AZM和ETM,且占比较大。结合实地采样及检测数据推测,人类活动可能是影响西江河与锦江流域抗生素浓度高于其他研究流域的主要原因,同时研究流域检测结果也反映了在密集居民区抗生素的浓度明显高于人口稀少地区,说明抗生素的污染与经济发展程度以及人口密集程度密切相关。
表4 流域抗生素分布
Table 4 Antibiotic distribution in river basin
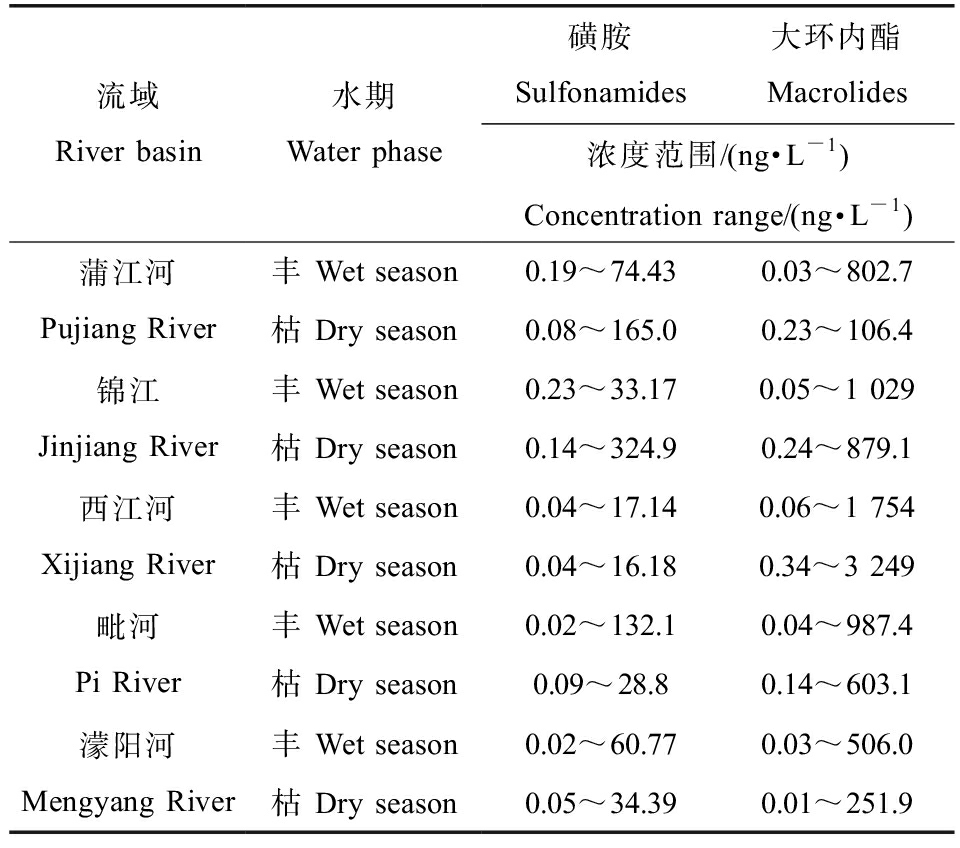
流域River basin水期Water phase磺胺Sulfonamides大环内酯Macrolides浓度范围/(ng·L-1)Concentration range/(ng·L-1)蒲江河Pujiang River丰 Wet season0.19~74.430.03~802.7枯 Dry season0.08~165.00.23~106.4锦江Jinjiang River丰 Wet season0.23~33.170.05~1 029枯 Dry season0.14~324.90.24~879.1西江河Xijiang River 丰 Wet season0.04~17.140.06~1 754枯 Dry season0.04~16.180.34~3 249毗河Pi River丰 Wet season0.02~132.10.04~987.4枯 Dry season0.09~28.80.14~603.1濛阳河Mengyang River丰 Wet season0.02~60.770.03~506.0枯 Dry season0.05~34.390.01~251.9
抗生素在不同水环境中的残留差异在一定程度上反映了该区域抗生素使用的特征。由图5可知,2类抗生素在研究流域中广泛分布。西江河流域(S12~S17)研究段位于成都市东部地区,人口密集,经济活动较为频繁,汽车产业较为发达,流域两岸存在道路以及建筑施工,累积浓度最高的点位于S14和S16,分别为5.21 μg·L-1和3.52 μg·L-1,其中S14点在2个水期中累积浓度表现均比较高。由于西江流域本身全年流量均匀,水体自身交换能力相对较弱,自净能力也相对较差,抗生素在水体中的持续累积和难迁移,导致西江河流域累积浓度远高于其他研究流域。锦江流域(S7~S11)主要流经成都市主城区,人口众多,抗生素浓度受人为活动因素较大,S10累积浓度最高,为1.84 μg·L-1。毗河流域(S18~S23)位于成都市东北部,人为活动较为频繁,存在分散性的工业园,且两岸附有农业种植,累积浓度最高的点位于S21,为1.14 μg·L-1,由于居民生活垃圾中残留的少量抗生素可能通过雨水冲刷经地表径流汇入流域水体,增加水体抗生素浓度,导致毗河流域抗生素浓度仅次于西江河及锦江流域。蒲江河(S1~S6)及濛阳河(S24~S31)流域无论是在经济发展还是人口数量都明显低于其余3条流域,抗生素污染主要来源于农业种植和个体家禽散养户,累积浓度最大点位于S29和S4,分别为696.5 ng L-1和1.32 μg·L-1。S27为所有采样点中累积浓度最小的点位,因其处于濛阳河流域支流最上游,沿途居民较少,不存在工业源,同时没有其他监测点位水体抗生素的叠加影响,加之河流自身的稀释和自净作用,所以其累积质量浓度较低。
L-1和1.32 μg·L-1。S27为所有采样点中累积浓度最小的点位,因其处于濛阳河流域支流最上游,沿途居民较少,不存在工业源,同时没有其他监测点位水体抗生素的叠加影响,加之河流自身的稀释和自净作用,所以其累积质量浓度较低。
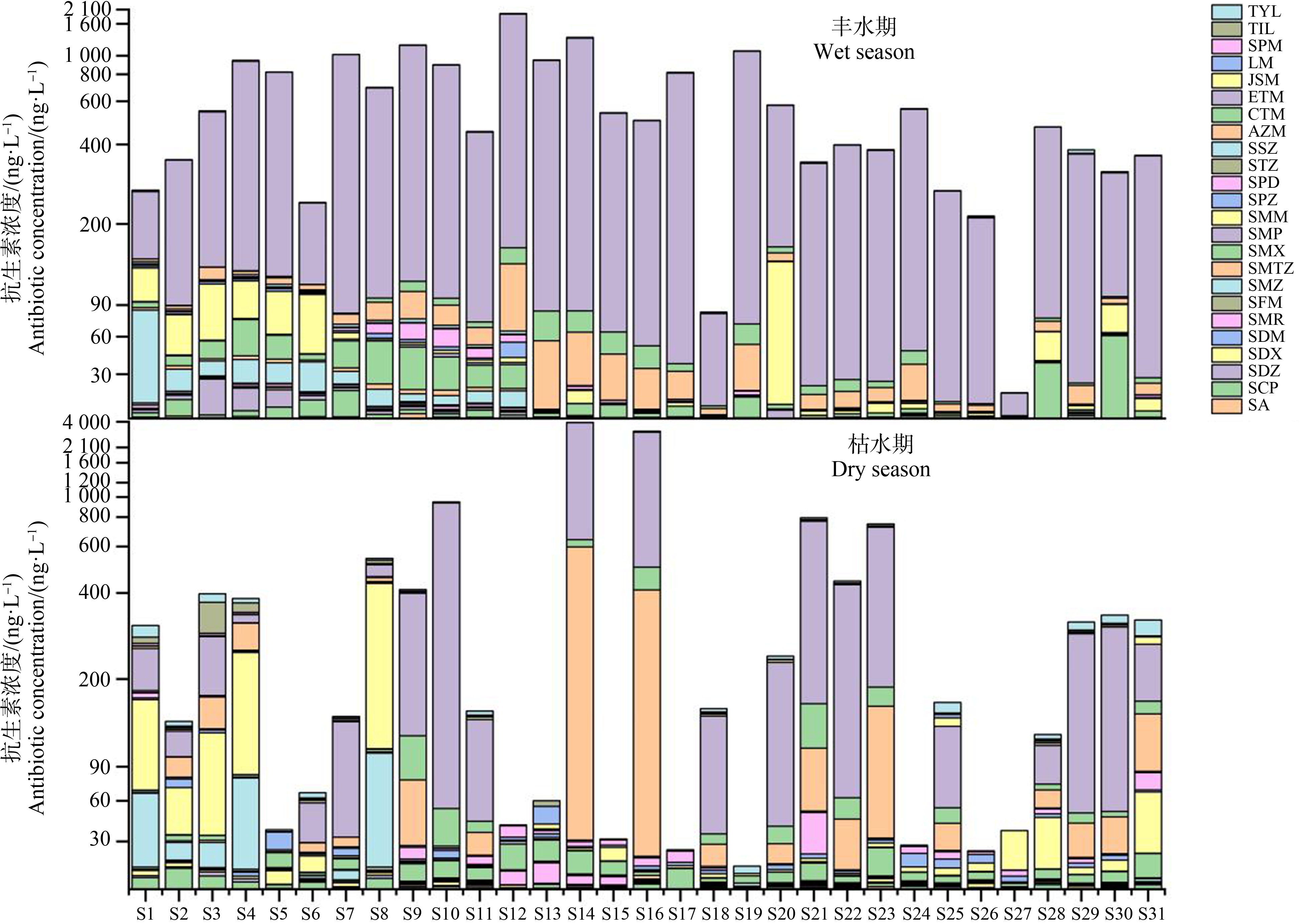
图5 抗生素浓度空间分布图
Fig. 5 Spatial distribution of antibiotic concentration
2.4 生态风险评价
目前国内还未有关于抗生素污染物的评价标准,因此本文采用风险商值法(RQ)进行风险评估[29-30],公式如下:
RQ=MEC/PNEC
PNEC=L(E)C50或L(N)OEC/AF
式中:RQ为污染物的环境风险商,MEC为环境中的实际检测浓度,PNEC为环境污染物的预测无效应浓度。EC50或LC50为生物对目标物的半数效应或致死浓度,LOEC为最低效应浓度,NOEC为最低无效应浓度,毒性数据来自于已发表的国内外相关研究文献,AF为评价因子,急性毒性数据采用欧盟水框架指令推荐值1 000,慢性毒性数据满足3个营养级时,AF取10;满足2个营养级时AF取50;满足一个营养级时,AF取100。基于最严重的考虑情况,环境中实测浓度(MEC)选择最大值计算,每种抗生素对应的水生生物毒性敏感数据如表5所示。通过计算抗生素的RQ值来评价污染物对环境的危害,RQ<0.1,为低风险;0.1≤RQ<1,为中风险;RQ>1,为高风险[31]。
表5 磺胺和大环内酯类急性毒性数据
Table 5 Acute toxicity data of sulfa and macrolides

化合物Compounds受试物种Species毒性Toxicity半数效应浓度(EC50)/(mg·L-1)The median effect concentration (EC50)/(mg·L-1)评估因子(AF)Assessment factor (AF)预测无效应浓度(PNEC)/(ng·L-1)Predicted no-effect concentration (PNEC)/(ng·L-1)参考文献ReferenceSCPLemma minor急性 Acute2.331 0002 330[32]SDZS. capricornutum急性 Acute2.21 0002 200[33]慢性 Chronic0.0001(NOEC)500.2[11]SDXLemna gibba急性 Acute1.247041 0001 247.04[34]慢性 Chronic193.3(NOEC)101 933[34]SDM急性 Acute9.851 0009 850[11]SMR急性 Acute11.91 00011 900[11]SMZS. vacuolatus急性 Acute19.521 00019 520[33]Lemma minor急性 Acute17.41 00017 400[2]SMXS. leopoliesis急性 Acute0.0271 00027[35]Ceriodaphnia dubia急性 Acute0.211 000210[34]Lemna gibba慢性 Chronic1.2(NOEC)100120[36]SMPChlorella fusca var. vacuolata急性 Acute3.82(LC50)1 0003 820[32]SMMAlgae急性 Acute8.561 0008 560[4]SPDLemma minor急性 Acute0.461 000460[33]Chlorella fusca var. vacuolata急性 Acute5.281 0005 280[3]Hydra vulgaris慢性 Chronic1 000(NOEC)1010 000[37]STZChlorella fusca var. vacuolata急性 Acute13.11 00013 100[32]Daphnia magna慢性 Chronic2(NOEC)100200[38]AZM急性 Acute1.9711 0001 971[39]急性 Acute0.151 000150[4]CTMS. capricornutum急性 Acute10.131 00010 030[39]ETMAnabaena sp.急性 Acute0.0221 00022[39]慢性 Chronic0.31(NOEC)10031[11]SPMAlgae急性 Acute0.691 000690[39]TYLMicrocystis aeruginosa急性 Acute0.951 000950[4]
注:NOEC表示无观察效应浓度,LC50表示半数致死浓度。
Note: NOEC means no observed effect concentration; LC50 means median lethal concentration.
以研究流域2个水期地表水中抗生素的实际检测浓度分别计算抗生素的风险商值。对其中16种抗生素进行生态风险评估,其余8种抗生素因未查到相关的PNEC数据,此研究不对其进行评估。生态风险商评价结果如图6所示。单个抗生素以ETM和SMX生态风险较高,AZM次之,其中ETM较为显著。不同水期时,磺胺类抗生素SMP、SMR、SMZ、SDM、SCP、SDZ、SDX、STZ、SMM、SPD以及大环内酯类抗生素CTM、SPM和TYL的RQ值均<0.1,无明显生态风险,在风险程度上大环内酯类高于磺胺类。丰水期时,抗生素生态风险水平较高,ETM仅在S27表现为中风险,其余所有点位RQ值均高于1,处于高风险水平,大部分点位SMX的RQ高于0.1,处于中风险及以上水平。所有研究流域中ETM、蒲江河及锦江流域中SMX的RQ均>1,对生态环境的危害作用较大。枯水期时,研究流域中抗生素风险水平同样较高,但较丰水期有所降低,所有流域中的SMX和ETM的RQ均>0.1,处于中风险及以上水平,AZM仅在西江河流域表现为中风险,其余4条流域表现为低风险。

图6 抗生素丰水期和枯水期风险商(RQs)值
Fig. 6 Risk quotients (RQs) value of antibiotics in wet and dry periods
由于抗生素在水体中多以复合污染的形式存在,且复合污染形式下的抗生素可能表现加和毒性。因此,经过风险简单叠加模型计算2个水期的RQ分析,ETM在5条研究河流流域中的RQ均高于1,SMX均高于0.1,说明ETM和SMX的浓度水平对成都市水生生物具有较高的急性或慢性毒性风险,5条流域风险水平依次为西江河、锦江、毗河、蒲江及濛阳河流域。
综上,本研究表明:
(1)在选取的5条研究流域地表水中,抗生素呈现出不同程度污染。24种抗生素在所选5条小流域中均有检出。磺胺类中SMX和SMM检出率最高,均为100%;大环内酯中JSM和TIL检出率最高,分别为88.7%和87.0%。24种抗生素检出的浓度范围为0.01~3 249 ng·L-1,平均浓度为25.9 ng·L-1,其中ETM平均浓度最高,其次是AZM、SMM和SMX。
(2)抗生素整体浓度丰水期大于枯水期。丰水期和枯水期浓度范围分别为0.02~1 754 ng·L-1和0.01~3 249 ng·L-1;平均浓度为29.49 ng·L-1和22.45 ng·L-1。在5条研究流域中,西江河流域中抗生素的污染程度普遍高于其他研究流域,且抗生素累积浓度最高的点处于该流域的S14,其次是锦江、毗河及蒲江河流域,濛阳河流域抗生素残留浓度最低,污染较其余流域也轻。
(3)运用风险商法分别评价研究流域中11种磺胺和5种大环内酯类抗生素在2个水期的生态风险程度。结果表明,大环内酯类风险程度大于磺胺类,丰水期时,抗生素生态风险水平较高,ETM仅在S27表现为中风险,其余点位RQ值均高于1,处于高风险水平;大部分点位SMX的RQ高于0.1,处于中风险及以上水平。枯水期时,研究流域中抗生素风险水平较丰水期有所降低,所有流域中的SMX和ETM的RQ均>0.1,处于中风险及以上水平,AZM仅在西江河流域表现为中风险,其余4条流域表现为低风险,5条流域生态风险程度依次为西江河>锦江>毗河>蒲江河>濛阳河,说明SMX和ETM为研究流域中主要的抗生素污染因子,需要采取措施控制水体环境抗生素污染,进一步加强抗生素的使用监管,减少抗生素对水生生物及人类健康的潜在影响。
[1] Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science &Technology, 2015, 49(11): 6772-6782
[2] Hernando M D, Mezcua M, Fernández-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments [J]. Talanta, 2006, 69(2): 334-342
[3] Sanderson H, Johnson D J, Reitsma T, et al. Ranking and prioritization of environmental risks of pharmaceuticals in surface waters [J]. Regulatory Toxicology and Pharmacology, 2004, 39(2): 158-183
[4] 汪涛, 杨再福, 陈勇航, 等. 地表水中磺胺类抗生素的生态风险评价[J]. 生态环境学报, 2016, 25(9): 1508-1514
Wang T, Yang Z F, Chen Y H, et al. Ecological risk assessment for sulfonamides in surface waters [J]. Ecology and Environmental Sciences, 2016, 25(9): 1508-1514 (in Chinese)
[5] Su H C, Liu Y S, Pan C G, et al. Persistence of antibiotic resistance genes and bacterial community changes in drinking water treatment system: From drinking water source to tap water [J]. Science of the Total Environment, 2018, 616-617: 453-461
[6] 祁彦洁, 刘菲. 地下水中抗生素污染检测分析研究进展[J]. 岩矿测试, 2014, 33(1): 1-11
Qi Y J, Liu F. Analysis of antibiotics in groundwater: A review [J]. Rock and Mineral Analysis, 2014, 33(1): 1-11 (in Chinese)
[7] Sapkota A, Sapkota A R, Kucharski M, et al. Aquaculture practices and potential human health risks: Current knowledge and future priorities [J]. Environment International, 2008, 34(8): 1215-1226
[8] Yang J F, Ying G G, Zhao J L, et al. Spatial and seasonal distribution of selected antibiotics in surface waters of the Pearl Rivers, China [J]. Journal of Environmental Science and Health Part B, Pesticides, Food Contaminants, and Agricultural Wastes, 2011, 46(3): 272-280
[9] García-Galán M J, Silvia Díaz-Cruz M, Barceló D, et al. Combining chemical analysis and ecotoxicity to determine environmental exposure and to assess risk from sulfonamides [J]. TrAC Trends in Analytical Chemistry, 2009, 28(6): 804-819
[10] 黄允省. 大环内酯类抗生素的研究新进展[J]. 临床合理用药杂志, 2018, 11(3): 164-165
[11] 王若男, 曹阳, 高超, 等. 沱江干流抗生素污染的时空变化和生态风险评估[J]. 环境化学, 2021, 40(8): 2505-2514
Wang R N, Cao Y, Gao C, et al. Spatial and seasonal variation of antibiotics and their associated ecological risk in Tuojiang River [J]. Environmental Chemistry, 2021, 40(8): 2505-2514 (in Chinese)
[12] 严清, 訾成方, 张怡昕, 等. 重庆主城区水域典型PhACs污染水平及生态风险评估[J]. 环境科学研究, 2013, 26(11): 1178-1185
Yan Q, Zi C F, Zhang Y X, et al. Pollution level and ecological risk assessment of typical pharmaceutically active compounds in the river basins of main districts of Chongqing [J]. Research of Environmental Sciences, 2013, 26(11): 1178-1185 (in Chinese)
[13] 巫明毫, 沙菁洲, 侯永斌, 等. 四川典型水域表层水体抗生素残留特征与风险评估[J]. 中国测试, 2020, 46(10): 78-85
Wu M H, Sha J Z, Hou Y B, et al. Characteristics and risk assessment of antibiotic residues in surface water of typical waters in Sichuan [J]. China Measurement &Test, 2020, 46(10): 78-85 (in Chinese)
[14] 许丹. 四川新药研发及对策研究[D]. 成都: 成都中医药大学, 2014: 39-40
[15] 丁剑楠, 刘舒娇, 邹杰明, 等. 太湖表层水体典型抗生素时空分布和生态风险评价[J]. 环境科学, 2021, 42(4): 1811-1819
Ding J N, Liu S J, Zou J M, et al. Spatiotemporal distributions and ecological risk assessments of typical antibiotics in surface water of Taihu Lake [J]. Environmental Science, 2021, 42(4): 1811-1819 (in Chinese)
[16] 银仁莉. 超声联合臭氧技术降解磺胺甲恶唑的研究[D]. 哈尔滨: 哈尔滨工业大学, 2014: 9
[17] 金磊, 姜蕾, 韩琪, 等. 华东地区某水源水中13种磺胺类抗生素的分布特征及人体健康风险评价[J]. 环境科学, 2016, 37(7): 2515-2521
Jin L, Jiang L, Han Q, et al. Distribution characteristics and health risk assessment of thirteen sulfonamides antibiotics in a drinking water source in East China [J]. Environmental Science, 2016, 37(7): 2515-2521 (in Chinese)
[18] 徐浩, 肖湘波, 唐文浩, 等. 海口城区地表水环境中抗生素含量特征研究[J]. 环境科学与技术, 2013, 36(9): 60-65
Xu H, Xiao X B, Tang W H, et al. Concentration characteristics of antibiotics in urban aquatic environment of Haikou [J]. Environmental Science &Technology, 2013, 36(9): 60-65 (in Chinese)
[19] 陈欣仪, 邓杰帆, 陈智锋. 南方某河流型地表水抗生素调查与风险研究[J]. 广东化工, 2018, 45(19): 56-58, 65
Chen X Y, Deng J F, Chen Z F. Investigation and risk study on antibiotics in the surface water of a southern river [J]. Guangdong Chemical Industry, 2018, 45(19): 56-58, 65 (in Chinese)
[20] Karthikeyan K G, Meyer M T. Occurrence of antibiotics in wastewater treatment facilities in Wisconsin, USA [J]. Science of the Total Environment, 2006, 361(1-3): 196-207
[21] 朱婷婷, 宋战锋, 尹魁浩, 等. 南方某水库水体中抗生素生态与健康风险研究[J]. 生态毒理学报, 2015, 10(5): 124-131
Zhu T T, Song Z F, Yin K H, et al. Assessments of ecological and health risk induced by antibiotics in source water of a reservoir in a southern city [J]. Asian Journal of Ecotoxicology, 2015, 10(5): 124-131 (in Chinese)
[22] 刘晓晖. 洞庭湖流域水环境中典型抗生素污染特征、来源及风险评估[D]. 济南: 山东师范大学, 2017: 2,36
[23] 洪蕾洁, 石璐, 张亚雷, 等. 固相萃取-高效液相色谱法同时测定水体中的10种磺胺类抗生素[J]. 环境科学, 2012, 33(2): 652-657
Hong L J, Shi L, Zhang Y L, et al. Simultaneous determination of 10 sulfonamide antibiotics in water by solid-phase extraction and high performance liquid chromatography [J]. Environmental Science, 2012, 33(2): 652-657 (in Chinese)
[24] Chen K, Zhou J L. Occurrence and behavior of antibiotics in water and sediments from the Huangpu River, Shanghai, China [J]. Chemosphere, 2014, 95: 604-612
[25] Yang J F, Ying G G, Zhao J L, et al. Spatial and seasonal distribution of selected antibiotics in surface waters of the Pearl Rivers, China [J]. Journal of Environmental Science and Health Part B, Pesticides, Food Contaminants, and Agricultural Wastes, 2011, 46(3): 272-280
[26] 薛保铭, 杨惟薇, 王英辉, 等. 钦州湾水体中磺胺类抗生素污染特征与生态风险[J]. 中国环境科学, 2013, 33(9): 1664-1669
Xue B M, Yang W W, Wang Y H, et al. Occurrence, distribution and ecological risks of sulfonamides in the Qinzhou Bay, South China [J]. China Environmental Science, 2013, 33(9): 1664-1669 (in Chinese)
[27] 杨俊, 王汉欣, 吴韵斐, 等. 苏州市水环境中典型抗生素污染特征及生态风险评估[J]. 生态环境学报, 2019, 28(2): 359-368
Yang J, Wang H X, Wu Y F, et al. Occurrence, distribution and risk assessment of typical antibiotics in the aquatic environment of Suzhou City [J]. Ecology and Environmental Sciences, 2019, 28(2): 359-368 (in Chinese)
[28] 刘昔, 王智, 王学雷, 等. 我国典型区域地表水环境中抗生素污染现状及其生态风险评价[J]. 环境科学, 2019, 40(5): 2094-2100
Liu X, Wang Z, Wang X L, et al. Status of antibiotic contamination and ecological risks assessment of several typical Chinese surface-water environments [J]. Environmental Science, 2019, 40(5): 2094-2100 (in Chinese)
[29] European Commission (EC). European Commission Technical Guidance Document in Support of Commission Directive 93//67/EEC on Risk Assessment for New Notified Substances and Commission Regulation (EC) No.1488/94 on Risk Assessment for Existing Substance, Part Ⅱ [R]. Brussels: European Commission, 2003: 100-103
[30] Vryzas Z, Alexoudis C, Vassiliou G, et al. Determination and aquatic risk assessment of pesticide residues in riparian drainage canals in northeastern Greece [J]. Ecotoxicology and Environmental Safety, 2011, 74(2): 174-181
[31] Hernando M D, Mezcua M, Fernández-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments [J]. Talanta, 2006, 69(2): 334-342
[32] Pro J, Ortiz J A, Boleas S, et al. Effect assessment of antimicrobial pharmaceuticals on the aquatic plant Lemna minor [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 70(2): 290-295
[33] Bia k-Bielińska A, Stolte S, Arning J, et al. Ecotoxicity evaluation of selected sulfonamides [J]. Chemosphere, 2011, 85(6): 928-933
k-Bielińska A, Stolte S, Arning J, et al. Ecotoxicity evaluation of selected sulfonamides [J]. Chemosphere, 2011, 85(6): 928-933
[34] Brain R A, Johnson D J, Richards S M, et al. Effects of 25 pharmaceutical compounds to Lemna gibba using a seven-day static-renewal test [J]. Environmental Toxicology and Chemistry, 2004, 23(2): 371-382
[35] Ferrari B, Mons R, Vollat B, et al. Environmental risk assessment of six human pharmaceuticals: Are the current environmental risk assessment procedures sufficient for the protection of the aquatic environment? [J]. Environmental Toxicology and Chemistry, 2004, 23(5): 1344-1354
[36] Lu G, Li Z, Liu J. Effects of selected pharmaceuticals on growth, reproduction and feeding of Daphnia magna [J]. Fresenius Environmental Bulletin, 2013, 22(9): 2583-2589
[37] Quinn B, Gagné F, Blaise C. An investigation into the acute and chronic toxicity of eleven pharmaceuticals (and their solvents) found in wastewater effluent on the cnidarian, Hydra attenuata [J]. Science of the Total Environment, 2008, 389(2-3): 306-314
[38] Park K, Kwak I S. Gene expression of ribosomal protein mRNA in Chironomus riparius: Effects of endocrine disruptor chemicals and antibiotics [J]. Comparative Biochemistry and Physiology Part C: Toxicology &Pharmacology, 2012, 156(2): 113-120
[39] 吴天宇, 李江, 杨爱江, 等. 赤水河流域水体抗生素污染特征及风险评价[J]. 环境科学, 2022, 43(1): 210-219
Wu T Y, Li J, Yang A J, et al. Characteristics and risk assessment of antibiotic contamination in Chishui River Basin, Guizhou Province, China [J]. Environmental Science, 2022, 43(1): 210-219 (in Chinese)