氟啶虫酰胺是一种新型吡啶酰胺类杀虫剂,对蚜虫等刺吸式口器害虫具有良好的防效,与新烟碱、有机磷、氨基甲酸酯和拟除虫菊酯类杀虫剂以及吡蚜酮均无交互抗性[1]。氟啶虫酰胺对哺乳动物、鸟类、鱼类、蜜蜂和有益节肢动物等的急性毒性为低毒或者无毒[1],自2003年以来已在中国、英国、法国和荷兰等全球40多个国家登记[2]。目前防治蚜虫等刺吸式口器害虫的常用杀虫剂之一为新烟碱类杀虫剂,而该类杀虫剂面临的抗性和蜜蜂毒性问题导致许多国家已禁止或限制使用该类杀虫剂部分品种。同时氟啶虫酰胺的原药正式登记保护期在2017年到期,引起国内外企业商业开发热潮[2-3]。据统计,2018年氟啶虫酰胺杀虫剂市场份额占有量达到0.28%[3]。
关于氟啶虫酰胺杀虫机理的研究表明,氟啶虫酰胺可迅速且不可逆地抑制刺吸式昆虫的取食行为导致昆虫饥饿而死[1]。进一步的研究表明,氟啶虫酰胺能破坏昆虫唾液腺和马氏管正常分泌活动[4]。此外,氟啶虫酰胺处理的蚜虫大部分腿部关节肿大,运动失调,表明氟啶虫酰胺作用于蚜虫的神经系统[5]。2018年,我国学者Ren等[4]利用生理学和电生理学研究发现氟啶虫酰胺的分子靶标为内向整流钾离子通道(inwardly-rectifying potassium channels, Kir),引起国内外学者,尤其是农药创制人员的关注。Kir几乎存在于所有动物细胞中,具有广泛组织分布性,在相应组织细胞内承担特定的生理功能,包括神经信号传导和细胞膜兴奋性的控制[6],被预测为开发杀虫剂的新分子靶点[7-9]。目前,仅有氟啶虫酰胺这一杀虫剂被报道作用于Kir。
氟啶虫酰胺被广泛用于稻田、茶园、果园及陆地、设施蔬菜半翅目害虫(包括蚜虫、白蚁)、小蓟马、蓟马、叶蝉和稻飞虱等害虫的防治。2019年,Metcalfe等[10]首次报道在加拿大安大略省五大湖流域检测到了氟啶虫酰胺,其浓度范围为0.79~1.75 μg·L-1。在中国南方珠江三角洲的农业土壤中检测浓度为0.26~0.27 ng·g-1 [11]。同时,氟啶虫酰胺水溶性为5.20 g·L-1 (20 ℃),具有向水生环境迁移的潜力[12]。而关于氟啶虫酰胺对环境非靶标生物的毒性研究鲜有报道。因此,基于氟啶虫酰胺的应用前景、特异的分子作用机理及环境暴露潜在可能性,需要更多的数据来评估其对水生生物的急性和慢性毒性。
斑马鱼(Danio rerio)是一种常用的水生模式生物,广泛应用于药物毒性与安全性评价及环境毒理学研究,其基因与人类基因具有高度的相似性,并且具有独特的生物学、基因组学、遗传学优势和高度保守的疾病信号传导路径[13]。同时,鱼类和哺乳动物具有高度相似的神经递质系统,其中鱼类大脑中的侧大脑皮层,被认为是海马体的进化前体,参与学习及记忆过程[14]。斑马鱼作为模式生物在药物作用分子靶标激活与修饰[15]、神经毒性效应与通路[16]以及行为研究[15,17]方面都有广泛应用,且形成了一定试验技术方法,已成为生物学家在实验室进行科学研究的新选择[13,18]。行为作为机体神经系统的一种重要功能,反映了神经细胞通信、整合和形态学的改变,可看作是神经系统多种感觉、运动和综合过程的最终产物。其中,新鱼缸潜水试验通过斑马鱼在新环境中的适应和探索行为的表现,被证明是研究焦虑样行为的一种有效方法[19-21];T型迷宫试验中通过对斑马鱼进行固定时间的训练,可测定其学习、记忆能力,被认为是研究学习、记忆行为最广泛的工具之一[22]。这2种方法均较为真实地反映斑马鱼的神经行为。本研究将斑马鱼成鱼在不同浓度的氟啶虫酰胺溶液中暴露21 d后,采用新鱼缸潜水试验、T型迷宫试验观察氟啶虫酰胺对斑马鱼成鱼行为影响,并进行生化水平分析和基因表达水平分析,探讨氟啶虫酰胺慢性暴露对斑马鱼成鱼神经行为毒性影响。
1 材料与方法(Materials and methods)
1.1 材料与试剂
斑马鱼成鱼(4~6月龄),购于北京高峰水族馆,体长2.50~3.50 cm,体质量0.20~0.30 g。97.1%氟啶虫酰胺原药(CAS:158062-67-0),陕西美邦药业集团股份有限公司。二甲基亚砜(DMSO)为分析纯,购自北京广达恒益科技有限公司。多巴胺ELISA检测试剂盒和皮质醇ELISA检测试剂盒均为北京雪杰特科技有限公司产品;TRNzol Universal总RNA提取试剂盒购自金连宝生物技术(北京)有限公司;Hifair® Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)试剂盒和Hieff UNICON® Universal Blue qPCR SYBR Green Master Mix试剂盒为翌圣生物科技(上海)股份有限公司产品;TaKaRa TaqTM试剂盒为宝日医生物技术(北京)有限公司产品。引物序列合成和基因测序由北京六合华大基因科技有限公司完成。
1.2 仪器与设备
动物运动轨迹跟踪系统(Noldus EthoVision XT 14,诺达思(北京)信息技术有限责任公司,荷兰),荧光定量PCR仪(QuantStudio 3,赛默飞世尔科技有限公司,美国),PCR仪(T100TMThermal Cycler,美国Bio-Rad公司,美国),多功能酶标仪(Infinite M200 PRO型,瑞士TECAN公司,瑞士),研磨器(OSE-Y30,金恩来生物技术(北京)有限公司,中国),液质联用仪(TRIPLE QUADTM 3500,AB公司,美国),多功能水质参数测定仪(SG68,梅特勒-托利多仪器(上海)有限公司,中国)、玻璃鱼缸(8 L,北京高峰水族馆,中国)。
1.3 实验方法
1.3.1 斑马鱼驯化
斑马鱼成鱼在实验室驯养7 d以上。驯养用水为自来水经曝气去氯处理24 h以上,pH值为7~8,溶解氧饱和度>80%,硬度为185~215 mg·L-1 (以CaCO3计);温度为27~28 ℃,光暗周期为14 h/10 h (光照时间8:00—22:00),每日投喂饲料2次。驯养期间自然死亡率低于5%。
1.3.2 暴露试验
DMSO配制10.0 g·L-1氟啶虫酰胺贮备液,储存于4 ℃。实验中的暴露药液使用去氯24 h以上的曝气自来水进行稀释,暴露药液中的DMSO含量不超过0.01% (V∶V)。
本实验室前期工作中氟啶虫酰胺对斑马鱼成鱼的急性毒性试验结果为LC50值>900 mg a.i.·L-1,对斑马鱼成鱼的毒性为低毒。因此,根据目前已报道的氟啶虫酰胺水环境中浓度范围0.79~1.75 μg·L-1[10],设置10 μg·L-1为本试验处理组的中浓度,1 μg·L-1和100 μg·L-1分别为处理组的低和高浓度,同时设置空白对照组。每个浓度设置3个重复,每个重复随机放置25条大小一致的斑马鱼成鱼于5 L暴露液中,暴露周期为21 d。在暴露期间,每48 h更换暴露溶液,并清洗容器。设置温度为27~28 ℃,光暗周期为14 h∶10 h (光照∶黑暗),光照强度80 lx。试验期间及时清除死鱼并统计各组死亡数。
1.3.3 暴露溶液中氟啶虫酰胺的实测浓度
为了确定暴露浓度中氟啶虫酰胺的实际浓度,在暴露第1天配制暴露溶液后(0 h)和第1次换水前(48 h)分别收集10 mL水样,参考马明等[23]的方法采用液质联用仪进行浓度分析。
1.3.4 新鱼缸潜水试验
暴露21 d后每重复取5条鱼进行新鱼缸潜水试验,参考Dong等[24]的试验方法并略加修改,测试装置为梯型鱼缸(图1)。测试开始前,梯型鱼缸中加入曝气自来水至10 cm深度,并在距离缸底5 cm处划一条水平线,将水体分为上下2层(图1),摄像机镜头正对水平线。行为测试时,从暴露缸中随机取5条成鱼依次进行行为观察,并采集视频5 min(鱼接触水面开始计时)用于行为分析。EthoVision XT 14分析焦虑样行为相关的指标包括:(1)上半部路程与总路程比值,即试验鱼5 min内在水平线上方水域的游动路程与总游动路程的比值;(2)在上部时间,即试验鱼5 min内在水平线上方水域的游动时间;(3)第1次上浮时间,即试验鱼第1次从下层水域越过水平线进入上层水域的时间;(4)穿梭次数,即试验鱼在两部分水域间的穿梭次数。
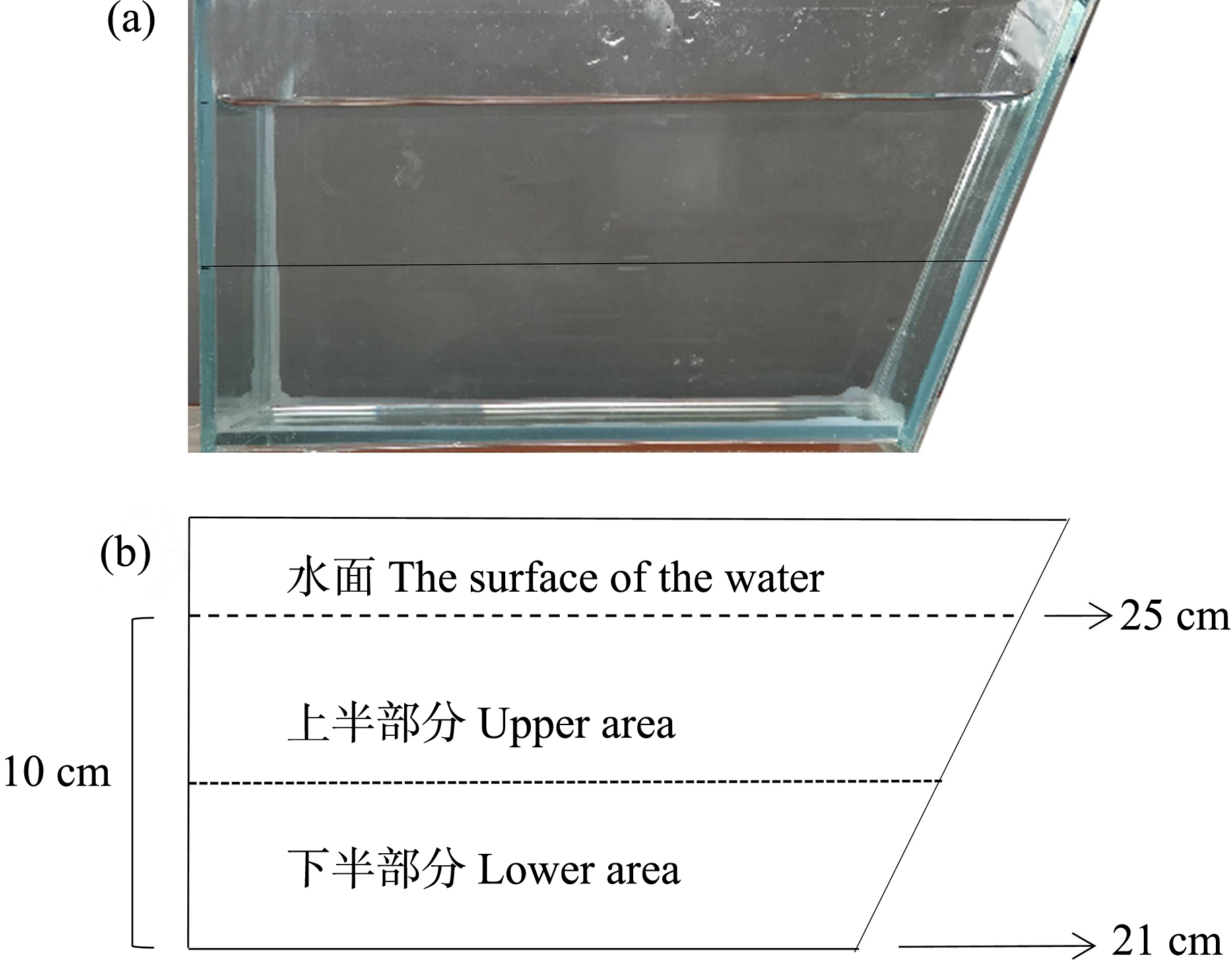
图1 新鱼缸潜水试验装置图
注:(a) 实物图;(b) 示意图。
Fig. 1 Diagram of the novel tank test apparatus
Note: (a) Picture of fishbowl; (b) Diagram.
1.3.5 T型迷宫试验
T型迷宫由透明玻璃制成(图2),分为1个长臂(长×宽×高=50 cm×10 cm×10 cm)和2个短臂(长×宽×高=20 cm×10 cm×10 cm)两部分。长臂的最前端为启动区域,长、宽、高均为10 cm,左臂和右臂分别套上红色和绿色的袖套。试验过程中,T型迷宫中注入8 cm深的曝气水。暴露21 d后每重复取5条鱼单独进行T型迷宫试验,参考Pilehvar等[25]的检测方法。试验分为2个阶段:(1)训练阶段,目的是通过食物刺激,使斑马鱼将目标区域与食物相联系,培养斑马鱼的学习记忆能力。在训练过程中,开启右臂作为目标区域,同时关闭左臂。将每条鱼在启动区域释放,让斑马鱼在T迷宫中自由探索3 min,同时在目标区域中撒入适量饲料作为食物奖励。如果斑马鱼在3 min内未到达目标区域,将使用饲料进行引导,并在目标区域停留1 min后捞出,训练时间为每天9:00—15:00,连续7 d每天1次,并仅在训练时进行喂食。(2)测试阶段,训练完成后的第2天进行测试来评估斑马鱼的学习记忆能力。在此阶段,摄像机位于鱼缸正上方,左右臂同时开启,将每条鱼在启动区域释放,从斑马鱼进入启动区域开始计时,让斑马鱼在T型迷宫中自由探索5 min,不以食物作为奖励,不进行引导,采集视频用于后续行为分析。EthoVision XT 14分析学习记忆行为相关的指标包括:(1)到达正确臂次数,即试验鱼在5 min内到达目标区域的次数;(2)中间臂停留时间,即试验鱼在缓冲区域的迟疑时间;(3)正确臂内游动速率,即试验鱼在目标区域的活跃状态;(4)第1次到达正确臂的时间,即试验鱼第1次进入目标区域所花费的时间。
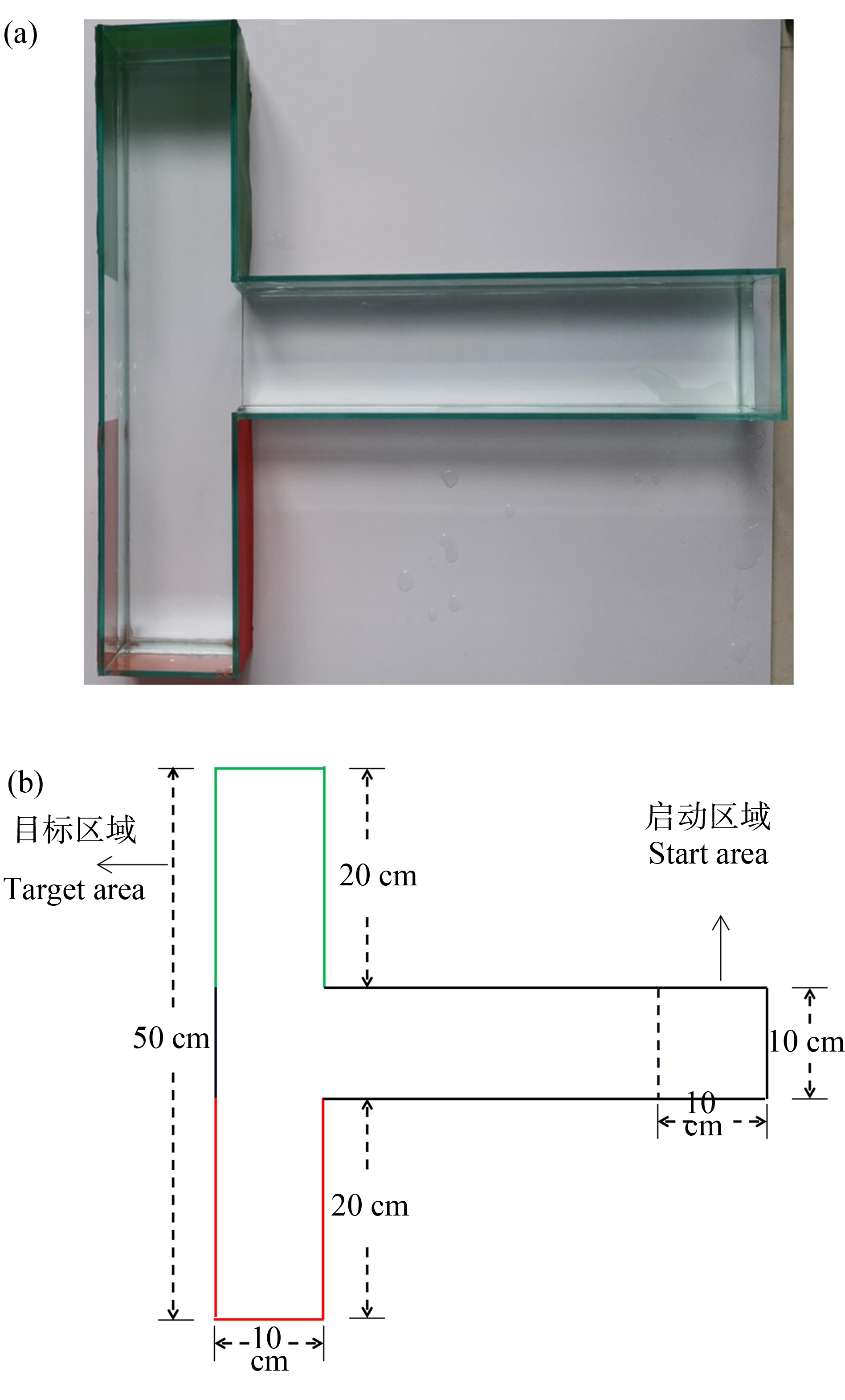
图2 T型迷宫试验装置
注:(a) 实物图;(b) 示意图。
Fig. 2 Diagram of T-maze test apparatus
Note: (a) Picture of fishbowl; (b) Diagram.
1.3.6 多巴胺和皮质醇含量测定
21 d暴露试验完成后,每个重复取5条成鱼,分别取脑组织(约0.0150 g),加入0.9%的生理盐水1 mL。用研磨器充分匀浆,3 000 r·min-1离心10 min后收集上清液并分装,置于-20 ℃保存。按照ELISA检测试剂盒测定多巴胺和皮质醇的含量。
1.3.7 miga2等行为相关基因表达量测定
21 d暴露试验完成后,每重复取5条成鱼的脑组织(约0.0150 g),加入1 mL TRNzol Universal试剂,根据RNA提取试剂盒说明书提取总RNA,使用酶标仪测定总RNA浓度。获得的RNA溶液分装后置于-80 ℃冰箱保存。取1 μg RNA,使用Hifair® Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)试剂盒将RNA反转录合成cDNA,采用TaKaRa TaqTM试剂盒进行PCR扩增,通过琼脂糖凝胶电泳对目的片段的大小进行验证,并通过测序进一步验证扩增片段的准确性。选取核糖体蛋白L13A (ribosomal protein L13A, rpl13a)和酸性核糖体蛋白大亚基P0 (ribosomal protein, large, P0, rplp0)同时作为内参基因,引物设计如表1所示,根据Hieff UNICON® Universal Blue qPCR SYBR Green Master Mix试剂盒进行荧光定量PCR扩增,目的基因表达水平用2-ΔΔCt法进行计算处理。
表1 基因引物
Table 1 Sequences of primers for the genes
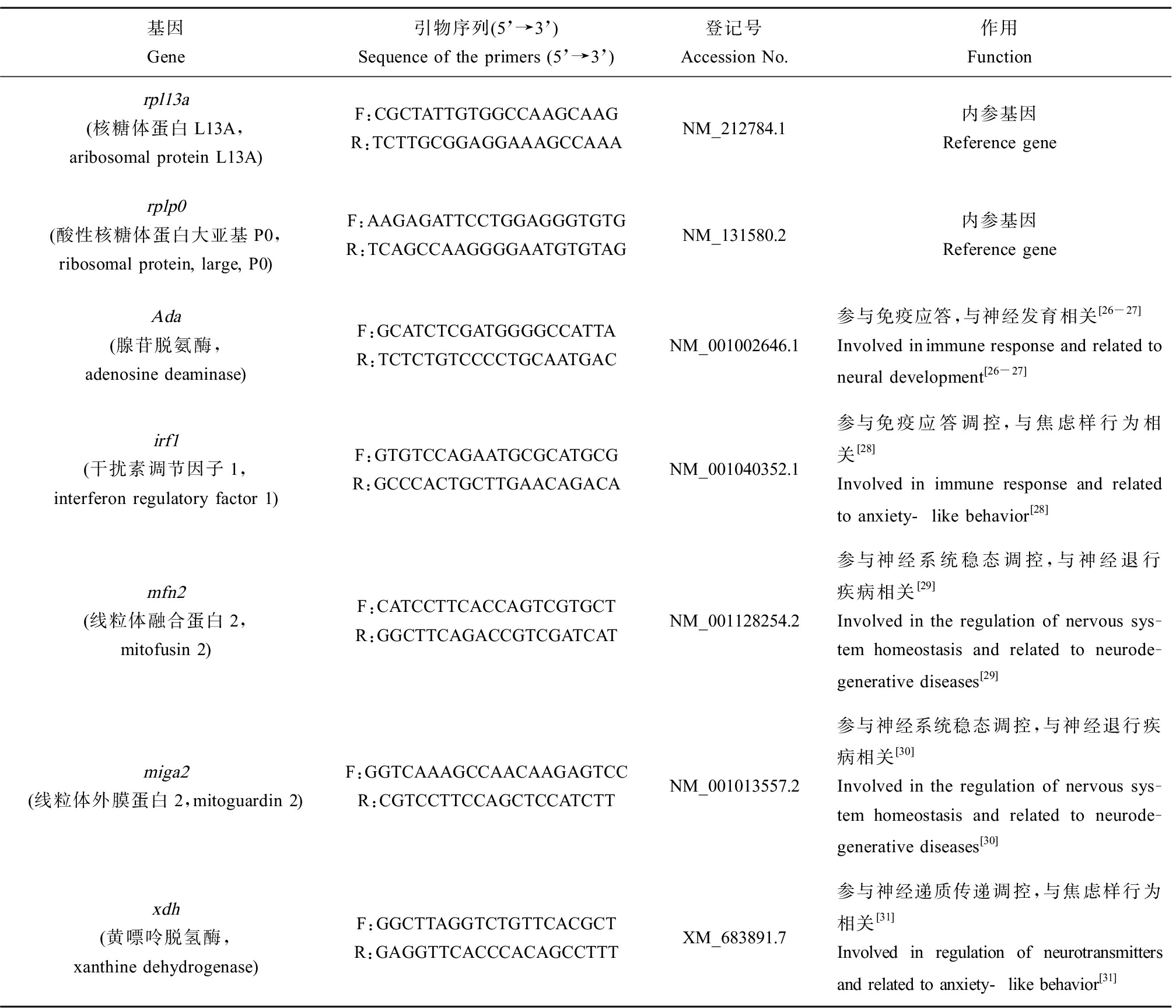
基因Gene引物序列(5’→3’)Sequence of the primers (5’→3’)登记号Accession No.作用Functionrpl13a(核糖体蛋白L13A,aribosomal protein L13A)F:CGCTATTGTGGCCAAGCAAGR:TCTTGCGGAGGAAAGCCAAANM_212784.1内参基因Reference generplp0(酸性核糖体蛋白大亚基P0,ribosomal protein, large, P0)F:AAGAGATTCCTGGAGGGTGTGR:TCAGCCAAGGGGAATGTGTAGNM_131580.2内参基因Reference geneAda(腺苷脱氨酶,adenosine deaminase)F:GCATCTCGATGGGGCCATTAR:TCTCTGTCCCCTGCAATGACNM_001002646.1 参与免疫应答,与神经发育相关[26-27]Involved inimmune response and related to neural development [26-27]irf1(干扰素调节因子1,interferon regulatory factor 1)F:GTGTCCAGAATGCGCATGCGR:GCCCACTGCTTGAACAGACANM_001040352.1参与免疫应答调控,与焦虑样行为相关[28]Involved in immune response and related to anxiety-like behavior[28]mfn2(线粒体融合蛋白2,mitofusin 2)F:CATCCTTCACCAGTCGTGCTR:GGCTTCAGACCGTCGATCATNM_001128254.2参与神经系统稳态调控,与神经退行疾病相关[29]Involved in the regulation of nervous sys-tem homeostasis and related to neurode-generative diseases[29]miga2(线粒体外膜蛋白2,mitoguardin 2)F:GGTCAAAGCCAACAAGAGTCCR:CGTCCTTCCAGCTCCATCTTNM_001013557.2参与神经系统稳态调控,与神经退行疾病相关[30]Involved in the regulation of nervous sys-tem homeostasis and related to neurode-generative diseases[30]xdh(黄嘌呤脱氢酶,xanthine dehydrogenase)F:GGCTTAGGTCTGTTCACGCTR:GAGGTTCACCCACAGCCTTTXM_683891.7参与神经递质传递调控,与焦虑样行为相关[31]Involved in regulation of neurotransmitters and related to anxiety-like behavior[31]
1.3.8 数据处理
采用SPSS26.0进行单因素方差分析(P<0.05时表示处理组与对照组具有显著性差异),使用EXCEL、ORIGIN 2018进行图表绘制。
2 结果(Results)
2.1 试验鱼的死亡率
21 d暴露试验过程中斑马鱼的死亡情况统计如表2所示,死亡率均未超过10%,表明这3个暴露浓度对斑马鱼的存活率没有影响。
表2 暴露试验中斑马鱼的死亡率
Table 2 Zebrafish deaths during exposure tests
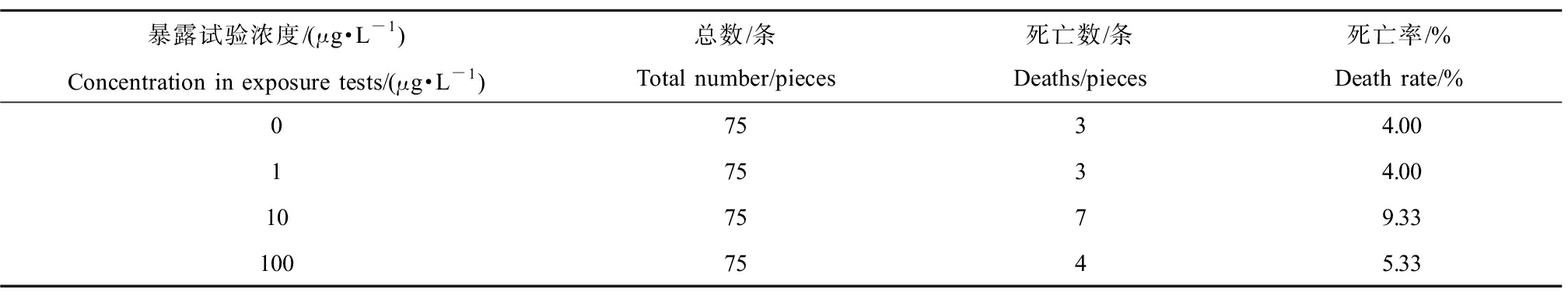
暴露试验浓度/(μg·L-1)Concentration in exposure tests/(μg·L-1)总数/条Total number/pieces死亡数/条Deaths/pieces死亡率/%Death rate/%07534.0017534.00107579.331007545.33
2.2 暴露溶液中氟啶虫酰胺的实测浓度
对处理组药液中的氟啶虫酰胺进行实际浓度的测定(表3)。结果表明,所有处理组水样的实测浓度与理论浓度均无显著性差异(P>0.05),说明氟啶虫酰胺在暴露试验中浓度保持相对稳定。
表3 暴露过程中氟啶虫酰胺的理论浓度和实测浓度
Table 3 The nominal and measured concentrations of flonicamid
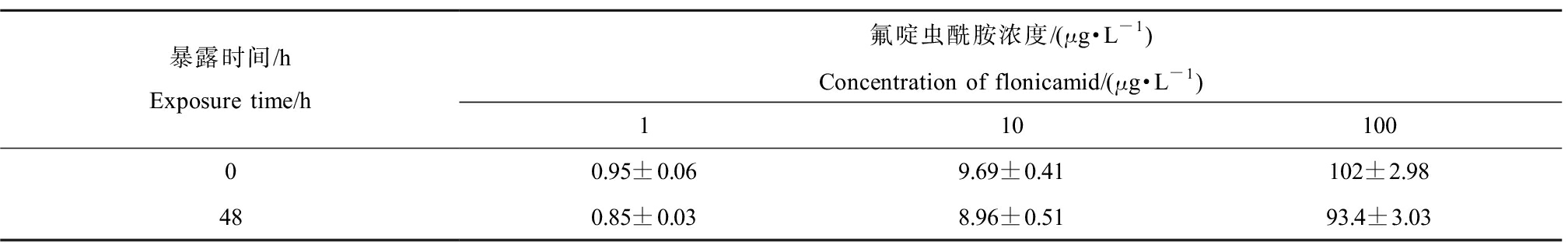
暴露时间/hExposure time/h氟啶虫酰胺浓度/(μg·L-1)Concentration of flonicamid/(μg·L-1)11010000.95±0.069.69±0.41102±2.98480.85±0.038.96±0.5193.4±3.03
2.3 新鱼缸潜水试验结果
新鱼缸潜水试验评估了斑马鱼在新环境中的焦虑样行为。在本研究中,对照组被试斑马鱼表现正常的寻求保护行为能力,在新鱼缸底部潜伏一定时间感到安全后开始探索上半部鱼缸区域,并多次穿梭于上下部鱼缸进行探索。而经过1、10和100 μg·L-1的氟啶虫酰胺21 d的慢性暴露后,与照组相比,被试斑马鱼成鱼第1次开始对上半部鱼缸探索时间、在鱼缸上部游动时间以及鱼缸上下部穿梭次数均呈现出降低趋势,表明斑马鱼成鱼表现一定的焦虑样行为。但是,当氟啶虫酰胺浓度为1、10和100 μg·L-1时,所测定的4个指标,即被试斑马鱼成鱼在上半部路程与总路程比值,在上部时间,第1次上浮时间和穿梭次数,与对照组均无显著差异(P>0.05) (图3)。
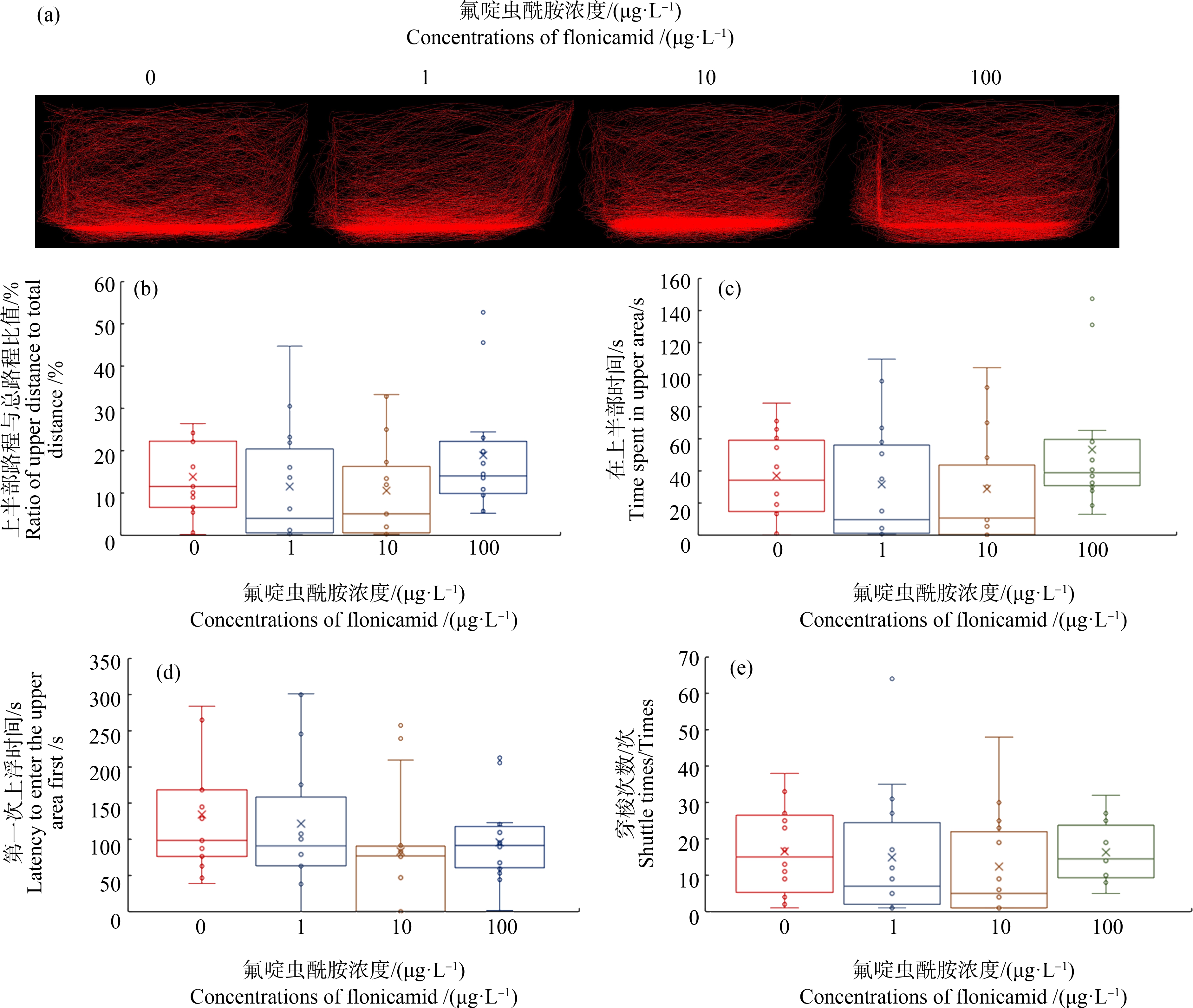
图3 21 d氟啶虫酰胺暴露后斑马鱼在新鱼缸潜水试验中的行为(n=14)
注:(a) 0、1、10、100 μg·L-1轨迹累加图;(b) 上半部路程与总路程比值;(c) 在上半部时间;(d) 第1次上浮时间;(e) 穿梭次数。
Fig. 3 Behavioral profiles of zebrafish after exposure to flonicamid for 21 d in the novel tank diving test (n=14)
Note: (a) Cumulative visualization image of zebrafish in each group 0, 1, 10, 100 μg·L-1; (b) Ratio of upper distance to total;(c) Time spent in upper area; (d) Latency to enter the upper; (e) Shuttle times.
2.4 T型迷宫试验结果
T型迷宫试验评估了斑马鱼的学习、记忆能力。在本研究的T型迷宫试验中(图4),对照组中被试斑马鱼成鱼能够迅速到达正确臂区域,并在那里探索、停留,这表明斑马鱼具有很强的记忆能力,可以迅速区分正确臂和错误臂。而经过1、10和100 μg·L-1的氟啶虫酰胺21 d慢性暴露,被试斑马鱼在中间臂停留时间和第1次到达正确臂时间均增加,即经过氟啶虫酰胺慢性暴露后,被试斑马鱼做出选择的时间增加。表明氟啶虫酰胺慢性暴露21 d后,被试斑马鱼成鱼学习、记忆行为受到一定的影响。但是,当氟啶虫酰胺浓度为1、10和100 μg·L-1时,与对照组相比,所测定的4个指标,即被试斑马鱼成鱼在测定时间内到达正确臂次数、正确臂内游动速率、中间臂停留时间和第1次到达正确臂时间无显著影响(P>0.05)。
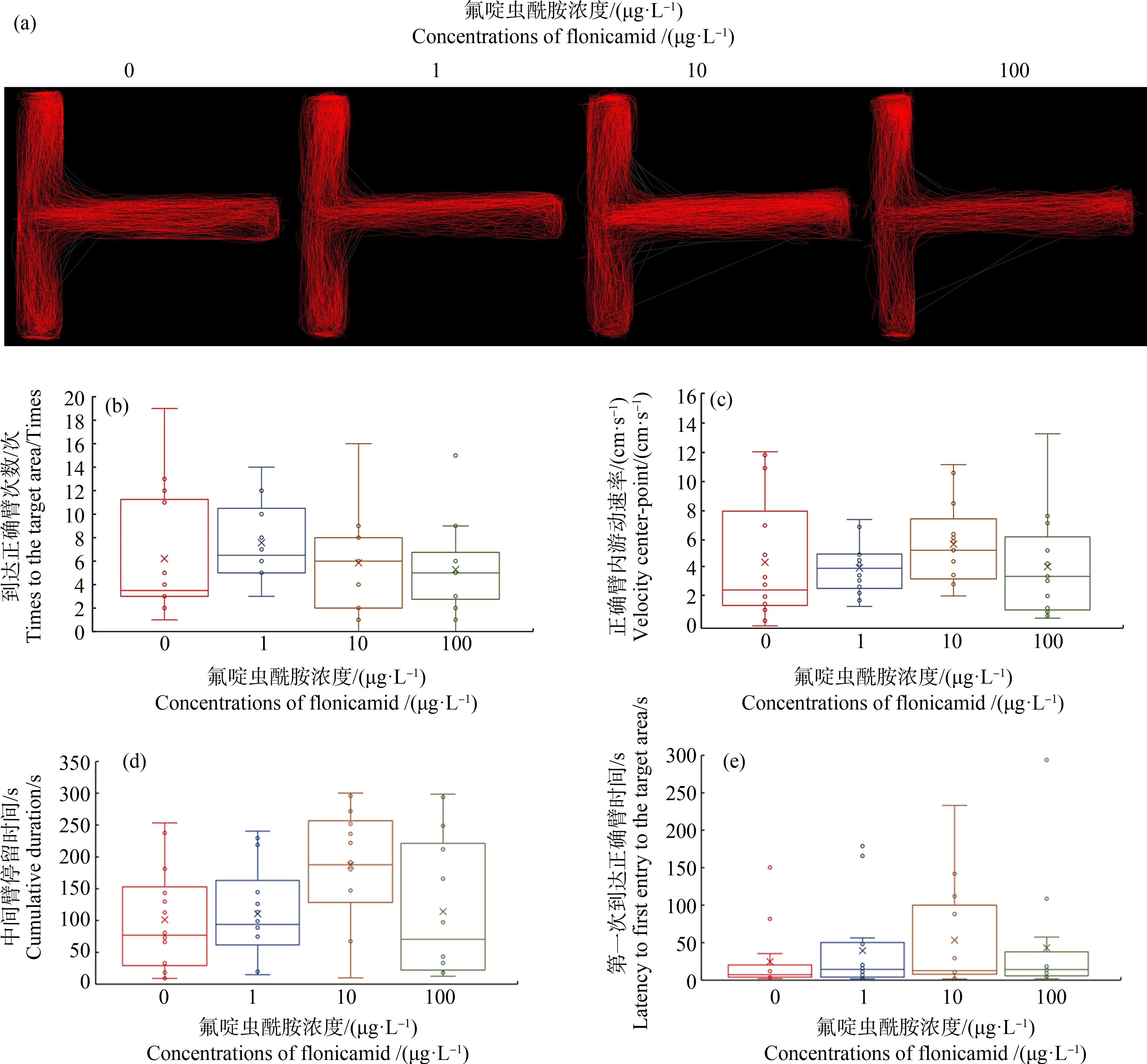
图4 氟啶虫酰胺21 d暴露后斑马鱼在T型迷宫试验中的行为(n=14)
注:(a) 0、1、10、100 μg·L-1轨迹累加图;(b) 到达正确臂次数;(c) 正确臂内游动速率;(d) 中间臂停留时间;(e) 第1次到达正确臂时间。
Fig. 4 Behavioral profiles of zebrafish after exposure to flonicamid for 21 d in T-maze test (n=14)
Note: (a) Cumulative visualization image of zebrafish in each group 0, 1, 10, 100 μg·L-1; (b) Times to the target area; (c) Velocity center-point; (d) Cumulative duration; (e) Latency to first entry to the target area.
2.5 氟啶虫酰胺暴露对斑马鱼多巴胺和皮质醇含量的影响
与行为观察一样,一些生理学指标可以为行为神经毒性研究提供有价值的数据。多巴胺是大脑中含量最丰富的儿茶酚胺类神经递质,在运动、认知行为中发挥重要作用[32]。斑马鱼皮质醇水平可以进一步评价斑马鱼的焦虑现象[33]。在本研究中,当氟啶虫酰胺浓度为1、10和100 μg·L-1,对斑马鱼暴露21 d后,被试斑马鱼脑组织中多巴胺和皮质醇的含量有一定的增高趋势,但与对照组相比无显著差异(P>0.05)(图5)。

图5 21 d暴露对斑马鱼多巴胺(a)和皮质醇(b)含量的影响
注:图中数据为平均值±标准误;柱上无符号标注表示无显著差异(P>0.05,单因素方差分析Tukey检验)。
Fig. 5 Effects on dopamine (a) and cortisol (b) contents in zebrafish after 21 d of exposure to flonicamid
Note: Data in the figure are expressed as mean±SE; unsigned labels above bars indicate no significant difference (P>0.05, Tukey’s test).
2.6 氟啶虫酰胺暴露对斑马鱼行为相关基因表达水平的影响
斑马鱼成鱼在不同浓度的氟啶虫酰胺中慢性暴露21 d后,脑组织中与行为神经毒性相关基因表达水平如图6所示。与对照组相比,当氟啶虫酰胺的浓度为1、10和100 μg·L-1时,miga2的表达水平显著降低(P<0.05);100 μg·L-1的氟啶虫酰胺暴露使xdh的表达水平显著升高(P<0.05)。而对ada、irf1和mfn2这3个基因的表达量无显著性影响(P>0.05)。这表明氟啶虫酰胺慢性暴露21 d后,斑马鱼神经系统稳态调控和焦虑样行为调控基因表达发生改变,而其行为可能随之受到影响。
3 讨论(Discussion)
氟啶虫酰胺是一种新型低毒吡啶酰胺类昆虫生长调节剂类杀虫剂,目前被证实作用于内向整流钾离子通道。由于其对蚜虫等刺吸式口器害虫具有较高活性和新烟碱类杀虫剂禁限用趋势,氟啶虫酰胺的使用逐渐增多。尽管尚未有报道氟啶虫酰胺对非靶标水生生物的影响,为了更科学、合理地使用氟啶虫酰胺,开展氟啶虫酰胺对环境非靶标生物毒性及其机制研究具有重要意义。斑马鱼行为评估是一种进行神经科学研究的强大、有效和简单的工具。行为反应通常被用作神经元内毒理学影响的敏感指标。
在本研究中,利用新鱼缸潜水试验和T型迷宫试验来评估氟啶虫酰胺长期慢性暴露下对斑马鱼成鱼焦虑、学习和记忆行为的影响。在新鱼缸潜水试验中,与对照组相比,经过1、10和100 μg·L-1的氟啶虫酰胺21 d的慢性暴露后,氟啶虫酰胺处理组斑马鱼成鱼很快地对鱼缸上部区域进行第1次探索。同时,更倾向在鱼缸下半部进行活动,且在上、下水域之间的穿梭次数略有减少。而对照组中的斑马鱼在暴露于新的鱼缸时,由于寻求保护的本能行为,会潜在缸底直到感到安全才会向鱼缸上半部进行探索[34]。在T型迷宫试验中,经过暴露的被试斑马鱼在中间臂停留时间和第1次到达正确臂时间均增加,即被试斑马鱼做出选择的时间增加。因此,氟啶虫酰胺21 d的慢性暴露后,被试斑马鱼出现轻微焦虑样行为,且学习、记忆行为轻微发生改变。但统计分析结果表明当氟啶虫酰胺浓度为1、10和100 μg·L-1时,所测定行为指标,与对照组均无显著差异(P>0.05)。Metcalfe等[10]在2019年首次报道了加拿大安大略省五大湖流域中氟啶虫酰胺残留浓度范围为0.79~1.75 μg·L-1,其他国家水环境残留量目前并没有报道。在本研究的1、10和100 μg·L-1范围内,氟啶虫酰胺并没有引起斑马鱼显著的行为改变,是否表明了在实际环境下氟啶虫酰胺对水生生物安全,需要开展更多的试验进行评估,如社会行为试验,光/暗、颜色偏好试验等[24],同时考虑设置高的浓度范围。

图6 21 d氟啶虫酰胺暴露对斑马鱼行为神经毒性相关基因表达水平的影响
注:图中数据为平均值±标准误;柱上*表示与对照组(0 μg·L-1)差异显著(P<0.05,单因素方差分析Tukey检验)。
Fig. 6 Effects of 21 d exposure of fonicamid on the expression of genes involved in the behavioral neurotoxicity of zebrafish
Note: Data in the figure are expressed as mean±SE; *indicates significant difference compared to the control group (0 μg·L-1), P<0.05 (Tukey’s test).
生理学指标可以为行为神经毒性研究提供有价值的数据。本研究中,经过1、10和100 μg·L-1的氟啶虫酰胺21 d的慢性暴露后,发现被试斑马鱼脑组织中的多巴胺和皮质醇含量均有升高趋势,但与对照组无显著性差异(P>0.05)。而miga2和xdh基因的表达水平受到显著影响(P<0.05)。
综上所述,斑马鱼成鱼慢性暴露于1、10和100 μg·L-1的氟啶虫酰胺21 d后,与斑马鱼神经系统形成发育相关基因miga2和xdh基因表达水平受到显著影响(P<0.05),可能引起其焦虑样行为和学习记忆行为受到轻微影响(P>0.05)。此外,研究表明,在神经细胞中,Kir通道对于细胞静息膜电位和调节动作电位持续时间至关重要[6],参与神经元的复极化过程[35]。同时,此通道在大脑等许多器官的功能中起着重要的生理作用[36],遭到破坏会引起通道病,如癫痫等与神经系统相关的疾病[37]。因此对于氟啶虫酰胺暴露后,是否会引起斑马鱼中Kir通道的损伤,需要更进一步的研究。本研究对氟啶虫酰胺环境暴露水生生物毒性预警具有重要的参考价值。同时,为了更科学、合理地使用氟啶虫酰胺,需要更系统深入的试验来评估氟啶虫酰胺的环境非靶标生物安全性。
[1] 仇是胜, 柏亚罗, 顾林玲. 氟啶虫酰胺的研究开发及市场前景[J]. 现代农药, 2014, 13(5): 6-11
Qiu S S, Bai Y L, Gu L L. Research, development and market prospect of flonicamid [J]. Modern Agrochemicals, 2014, 13(5): 6-11 (in Chinese)
[2] 苏建亚. 氟啶虫酰胺作用靶标: 内向整流钾离子通道研究进展[J]. 农药学学报, 2019, 21(2): 131-139
Su J Y. Molecular target of flonicamid: Inward-rectifying potassium channels [J]. Chinese Journal of Pesticide Science, 2019, 21(2): 131-139 (in Chinese)
[3] Sparks T C, Crossthwaite A J, Nauen R, et al. Insecticides, biologics and nematicides: Updates to IRAC’s mode of action classification: A tool for resistance management [J]. Pesticide Biochemistry and Physiology, 2020, 167: 104587
[4] Ren M M, Niu J G, Hu B, et al. Block of Kir channels by flonicamid disrupts salivary and renal excretion of insect pests [J]. Insect Biochemistry and Molecular Biology, 2018, 99: 17-26
[5] 沈娟. 新型杀虫剂: 氟啶虫酰胺对蚜虫的生物学活性[J]. 世界农药, 2011, 33(5): 19-22
[6] Hibino H, Inanobe A, Furutani K, et al. Inwardly rectifying potassium channels: Their structure, function, and physiological roles [J]. Physiological Reviews, 2010, 90(1): 291-366
[7] Piermarini P M, Inocente E A, Acosta N, et al. Inward rectifier potassium (Kir) channels in the soybean aphid Aphis glycines: Functional characterization, pharmacology, and toxicology [J]. Journal of Insect Physiology, 2018, 110: 57-65
[8] Li Z L, Davis J A, Swale D R. Chemical inhibition of Kir channels reduces salivary secretions and phloem feeding of the cotton aphid, Aphis gossypii (Glover) [J]. Pest Management Science, 2019, 75(10): 2725-2734
[9] Meng X K, Wu Z L, Yang X M, et al. Flonicamid and knockdown of inward rectifier potassium channel gene CsKir2B adversely affect the feeding and development of Chilo suppressalis [J]. Pest Management Science, 2021, 77(4): 2045-2053
[10] Metcalfe C D, Helm P, Paterson G, et al. Pesticides related to land use in watersheds of the Great Lakes Basin [J]. Science of the Total Environment, 2019, 648: 681-692
[11] Yu Z M, Li X F, Wang S R, et al. The human and ecological risks of neonicotinoid insecticides in soils of an agricultural zone within the Pearl River Delta, South China [J]. Environmental Pollution, 2021, 284: 117358
[12] 张亦冰. 新颖杀虫剂: 氟啶虫酰胺[J]. 世界农药, 2010, 32(1): 54-56
[13] Fishman M C. Genomics. Zebrafish: The canonical vertebrate [J]. Science, 2001, 294(5545): 1290-1291
[14] Gerlai R. Zebrafish and relational memory: Could a simple fish be useful for the analysis of biological mechanisms of complex vertebrate learning? [J]. Behavioural Processes, 2017, 141: 242-250
[15] Viscarra F, González-Gutierrez J, Esparza E, et al. Nicotinic antagonist UFR2709 inhibits nicotine reward and decreases anxiety in zebrafish [J]. Molecules, 2020, 25(13): E2998
[16] Zhang H, Zhao L J. Influence of sublethal doses of acetamiprid and halosulfuron-methyl on metabolites of zebra fish (Brachydanio rerio) [J]. Aquatic Toxicology, 2017, 191: 85-94
[17] Crosby E B, Bailey J M, Oliveri A N, et al. Neurobehavioral impairments caused by developmental imidacloprid exposure in zebrafish [J]. Neurotoxicology and Teratology, 2015, 49: 81-90
[18] 孙智慧, 贾顺姬, 孟安明. 斑马鱼: 在生命科学中畅游[J]. 生命科学, 2006, 18(5): 431-436
Sun Z H, Jia S J, Meng A M. Zebrafish: Swimming in life sciences [J]. Chinese Bulletin of Life Sciences, 2006, 18(5): 431-436 (in Chinese)
[19] Egan R J, Bergner C L, Hart P C, et al. Understanding behavioral and physiological phenotypes of stress and anxiety in zebrafish [J]. Behavioural Brain Research, 2009, 205(1): 38-44
[20] Maximino C, de Brito T M, da Silva Batista A W, et al. Measuring anxiety in zebrafish: A critical review [J]. Behavioural Brain Research, 2010, 214(2): 157-171
[21] Zhang S H, Liu X D, Sun M Z, et al. Reversal of reserpine-induced depression and cognitive disorder in zebrafish by sertraline and Traditional Chinese Medicine (TCM) [J]. Behavioral and Brain Functions, 2018, 14(1): 13
[22] Benvenutti R, Marcon M, Gallas-Lopes M, et al. Swimming in the maze: An overview of maze apparatuses and protocols to assess zebrafish behavior [J]. Neuroscience and Biobehavioral Reviews, 2021, 127: 761-778
[23] 马明, 陈默, 王鸣华. 氟啶虫酰胺高效液相色谱分析方法研究[J]. 世界农药, 2015, 37(3): 51-53
Ma M, Chen M, Wang M H. Quantitative analysis of flonicamid by HPLC [J]. World Pesticides, 2015, 37(3): 51-53 (in Chinese)
[24] Dong G P, Li X, Han G X, et al. Zebrafish neuro-behavioral profiles altered by acesulfame (ACE) within the range of “no observed effect concentrations (NOECs)” [J]. Chemosphere, 2020, 243: 125431
[25] Pilehvar A, Town R M, Blust R. The effect of copper on behaviour, memory, and associative learning ability of zebrafish (Danio rerio) [J]. Ecotoxicology and Environmental Safety, 2020, 188: 109900
[26] Cristalli G, Costanzi S, Lambertucci C, et al. Adenosine deaminase: Functional implications and different classes of inhibitors [J]. Medicinal Research Reviews, 2001, 21(2): 105-128
[27] Sauer A V, Hernandez R J, Fumagalli F, et al. Alterations in the brain adenosine metabolism cause behavioral and neurological impairment in ADA-deficient mice and patients [J]. Scientific Reports, 2017, 7: 40136
[28] 李雪平, 蔡晓丽, 曹立辉. 干扰素调节因子家族成员及功能简述[J]. 中国动物保健, 2020, 22(7): 71-72, 77
[29] 应岚, 卢中秋, 姚咏明. 线粒体融合蛋白2的结构与功能研究进展[J]. 生理科学进展, 2016, 47(2): 108-112
[30] 刘晓满. MIGA1/2促进线粒体融合并维持雌性小鼠生殖力[D]. 杭州: 浙江大学, 2015: 6-9
Liu X M. MIGA1/2Promote mitochondria fusion and are essential for female mouse fertility [D]. Hangzhou: Zhejiang University, 2015: 6-9 (in Chinese)
[31] Fan K Q, Li Y Y, Wang H L, et al. Stress-induced metabolic disorder in peripheral CD4+ T cells leads to anxiety-like behavior [J]. Cell, 2019, 179(4): 864-879
[32] Schultz W. Multiple functions of dopamine neurons [J]. F1000 Biology Reports, 2010, 2: 2
[33] Ramsay J M, Feist G W, Varga Z M, et al. Whole-body cortisol is an indicator of crowding stress in adult zebrafish, Danio rerio [J]. Aquaculture, 2006, 258(1-4): 565-574
[34] Levin E D, Bencan Z, Cerutti D T. Anxiolytic effects of nicotine in zebrafish [J]. Physiology & Behavior, 2007, 90(1): 54-58
[35] Silic M R, Murata S H, Park S J, et al. Evolution of inwardly rectifying potassium channels and their gene expression in zebrafish embryos [J]. Developmental Dynamics: An Official Publication of the American Association of Anatomists, 2022, 251(4): 687-713
[36] Kubo Y, Adelman J P, Clapham D E, et al. International Union of Pharmacology. LIV. Nomenclature and molecular relationships of inwardly rectifying potassium channels [J]. Pharmacological Reviews, 2005, 57(4): 509-526
[37] Pattnaik B R, Asuma M P, Spott R, et al. Genetic defects in the hotspot of inwardly rectifying K(+) (Kir) channels and their metabolic consequences: A review [J]. Molecular Genetics and Metabolism, 2012, 105(1): 64-72