双酚A(bisphenol A,BPA)是最常用的化工原料之一,广泛用于生产食品容器、热敏纸、婴儿奶瓶、医疗设备和电子产品等,导致其大量进入环境中。BPA具有较强的内分泌干扰效应,因此多个国家相继出台了一系列管控措施限制BPA的使用。为了应对这些管控措施,一些BPA类似物,如双酚S(bisphenol S, BPS)、双酚F(bisphenol F, BPF)等和双酚P(bisphenol P, BPP)等被开发用来替代BPA[1]。这些物质在长期使用过程中,会从产品中析出,因此,在环境介质如尘土、土壤、污泥和水、食品及食品包装容器、消费品及生物体内的检出量也越来越多。例如对日本、韩国和中国采集的河水和海水中,BPF在几个采样点的浓度甚至超过1 000 ng·L-1,而在日本东京的Tamagawa河水中,BPF浓度高达2 850 ng·L-1,并且多个站点的总双酚类物质的浓度超过了欧盟规定BPA对水生生物的预测无效应浓度(1 500 ng·L-1)[2],Liao和Kannan[3]对美国纽约奥尔巴的267份食品中的BPA、BPS、BPF和BPP等8种BPA及类似物进行了检测,发现75%的食品中检出了BPA类物质,总浓度的平均值为4.38 ng·g-1,其中,BPF和BPP在调味品芥末和姜中含量最高,分别为1 130 ng·g-1和237 ng·g-1,另外,这些BPA类似物在肉和肉制品、鱼和海鲜、蔬菜中均有不同程度的检出。最近的一项研究发现,在美国成人的重复饮食固体食物样本中也检测出不同浓度的BPS、BPZ、BPP和BPF等BPA类似物[4]。Li等[5]对181份中国孕妇血清样本中BPA类似物的检测发现,10种BPA类似物包括BPS、BPF、双酚AF (BPAF)和BPP等都有不同程度的检出。此外,Zhang等[6]对暨南大学160名学生尿液样本的检测也发现了BPA、BPAF、BPF和BPP等多种BPA类物质的存在,说明BPA类似物正通过不同的途径暴露于人体,并可能会对生态和人体健康产生危害。
在常见的BPA类似物中,尽管BPP在环境、食品和生物样本中的检出浓度比BPF和BPS稍低,但是对于大型溞和斑马鱼而言,BPP是毒性最强的BPA类似物[7]。任文娟等[8]研究了BPA类似物对斑马鱼的急性毒性效应,发现BPP对斑马鱼成鱼和胚胎的96 h-半数致死效应(LC50)值均比BPA和BPF低一个数量级,比BPS低4个数量级。根据《化学品分类和标签规范-第28部分:对水生环境的危害》(GB 30000.28—2013)对受试物的急性水环境毒性的分类指标判定BPP为毒性Ⅰ级(96 h-LC50≤1 mg·L-1)。在鸡D40细胞系测基因毒性的实验中,Lee等[9]发现BPP具有比BPA更强的基因毒性。在H295类固醇生成试验中,BPP能够引起孕激素和雌激素水平的升高,以及雄激素水平的下降[10]。Wang等[11]以摇蚊为模式生物,发现BPP对摇蚊具有内分泌干扰效应。此外,在水环境中,BPP比BPA更难降解[12-13],并且具有更强的生物蓄积性[14],更容易在生物体内富集,说明BPP的毒性效应不容忽视,但是BPP的毒性效应却未引起足够的关注。
环境污染物的暴露是长期慢性的暴露过程,但是BPP的长期慢性暴露对生长发育造成危害尚缺乏研究。本文以BPP为受试物,斑马鱼为模式生物,通过斑马鱼7 d孵化率、8 d累积死亡率、30 d畸形率、30 d生长抑制率和30~60 d特定生长率,以及雄鱼的激素和卵黄蛋白原水平等指标进行评价,探讨BPP对斑马鱼早期生命阶段的生长发育毒性,以期为BPP潜在的生态健康风险评价提供依据。
1 材料与方法(Materials and methods)
1.1 材料与试剂
BPP,纯度>98%,美国J&K公司;水为Milli-Q超纯水。雌二醇(E2)酶联免疫试剂盒,睾酮(T)酶联免疫试剂盒,卵黄蛋白原(VTG)酶联免疫试剂盒(96T),均购自上海酶联生物科技有限公司。
1.2 仪器与设备
显微镜(DM2500,德国Leica公司),冷冻离心机(2-16PK,美国Sigma公司),生态培养箱(CLIMACELL型,德国MMM公司),酶标仪(Infinite M200型,瑞士TECAN公司),多功能水质参数测定仪(HQ40d,美国HACH公司),电热恒温培养箱(INNOVA®43,郑州南北仪器设备有限公司)。
1.3 实验方法
1.3.1 斑马鱼驯化和胚胎收集
4月龄野生成年斑马鱼(AB型)购于中国科学院武汉水生生物研究所,并在实验室斑马鱼养殖系统中养殖并繁殖3代以上。系统运行期间,光照/黑暗周期设定为14 h∶10 h(光照∶黑暗),维持温度在(27±1) ℃,每天定时投喂丰年虾2次。雌鱼和雄鱼在光照刺激下交配产卵,收集质量高的胚胎,置于27 ℃恒温光照培养箱中待用。
1.3.2 暴露实验
参照OECD的化学品测试导则210“Early-life Stage Toxicity Test”[15]和215“Fish, Juvenile Growth Test”[16]要求,并稍作修改,进行斑马鱼的毒性试验。设定受精卵暴露剂量分别为0.1、0.2、0.3、0.4、0.6和0.8 mg·L-1,并设置空白对照,实验周期为60 d。将胚胎随机分配到1 L的孵化盒中,每个盒子放入150粒受精卵,每个浓度3个平行。将孵化盒置于生态培养箱中,设置温度为27 ℃,光照周期为14 h∶10 h(光照∶黑暗),光照强度设为50 lx。实验期间每日统计受精卵的孵化数量、胚胎及幼鱼的畸形数、幼鱼存活等情况,暴露30 d后每个浓度随机选出20条斑马鱼,使用麻醉剂MS 222进行麻醉后测定体长(cm)及体质量(g)。然后分别从上述各个浓度组中选取20条体质量在0.05~0.10 g之间的幼鱼,置于3 L的玻璃缸中继续暴露,玻璃缸放入恒温水浴池内,设置温度为(28±0.5) ℃,光照周期为14 h∶10 h(光照∶黑暗)。每天定时投喂丰年虫2次,喂食30 min后吸出食物残渣,每48 h更换暴露溶液。再暴露的45 d和60 d后使用麻醉剂MS 222进行麻醉,逐尾吸干水分,并测其体长(cm)和体质量(g)。
1.3.3 激素水平分析
暴露60 d后每个平行各取6条雄鱼用于性激素水平的测定,分别将每条鱼的头和尾部切下后合并,加入预冷的匀浆缓冲液和蛋白酶抑制。用匀浆器充分匀浆后收集上清液并分装,置于-80 ℃保存直至采用酶联免疫吸附法进行雌二醇、睾酮和卵黄蛋白原水平的测定。所有操作按照试剂盒的说明进行。
1.4 数据分析
根据单因素方差分析(ANOVA, SPSS19.0)法多重比较分析实验组与空白组间各观测指标的显著性差异,其中P<0.05认为差异显著(记作*),P<0.01认为差异显著(记作**)。采用Dunnett tests (Dunnett tests, ANOVA, SPSS19.0)将实验组的指标值与空白组相较,确定最低有效应浓度(LOEC)和最高无效应浓度(NOEC)。采用概率回归分析(Probit,SPSS19.0)分析引起10%、30%和50%的生长率变化的受试物浓度(EC10、EC30和EC50)。浓度-效应曲线通过Origin 8.0软件进行拟合。
斑马鱼“假定”特定生长率(specific growth rate, SGR)计算公式如下:
式中:SGR表示“假定”的特定生长率;w1、w2表示某尾鱼分别在t1、t2时的质量(或体长);lnw2表示试验结束时鱼体质量(或体长)的对数;![]() 表示试验开始时容器中鱼质量(或体长)w1的平均值的对数。
表示试验开始时容器中鱼质量(或体长)w1的平均值的对数。
2 结果(Results)
2.1 BPP对斑马鱼早期生命阶段的毒性效应
BPP对7 dpf斑马鱼孵化率的影响如图1(a)所示。BPP对斑马鱼孵化率的影响具有一定的浓度依赖性,随着浓度的增高,孵化率不断降低。在浓度为0.6 mg·L-1时,孵化率降低至40.00%,与空白对照组相比具有显著性差异(P<0.05);而0.8 mg·L-1 BPP将斑马鱼孵化率降低至24.67%(P<0.01)。在8 dpf对斑马鱼的累积死亡率(胚胎和仔鱼的累积死亡数与总胚胎数的比值)进行统计,发现BPP对斑马鱼死亡率的影响也具有明显的剂量-效应关系,随着BPP浓度的升高,斑马鱼的累积死亡率不断上升(图1(b)),0.2、0.3和0.4 mg·L-1 BPP暴露导致斑马鱼的死亡率分别达到21.33%、27.11%和31.67%,显著高于空白对照组(P<0.05);而当BPP浓度为0.6 mg·L-1和0.8 mg·L-1时,斑马鱼的死亡率分别达到51.33%和64.00%,与空白对照组相比显著升高(P<0.01)。
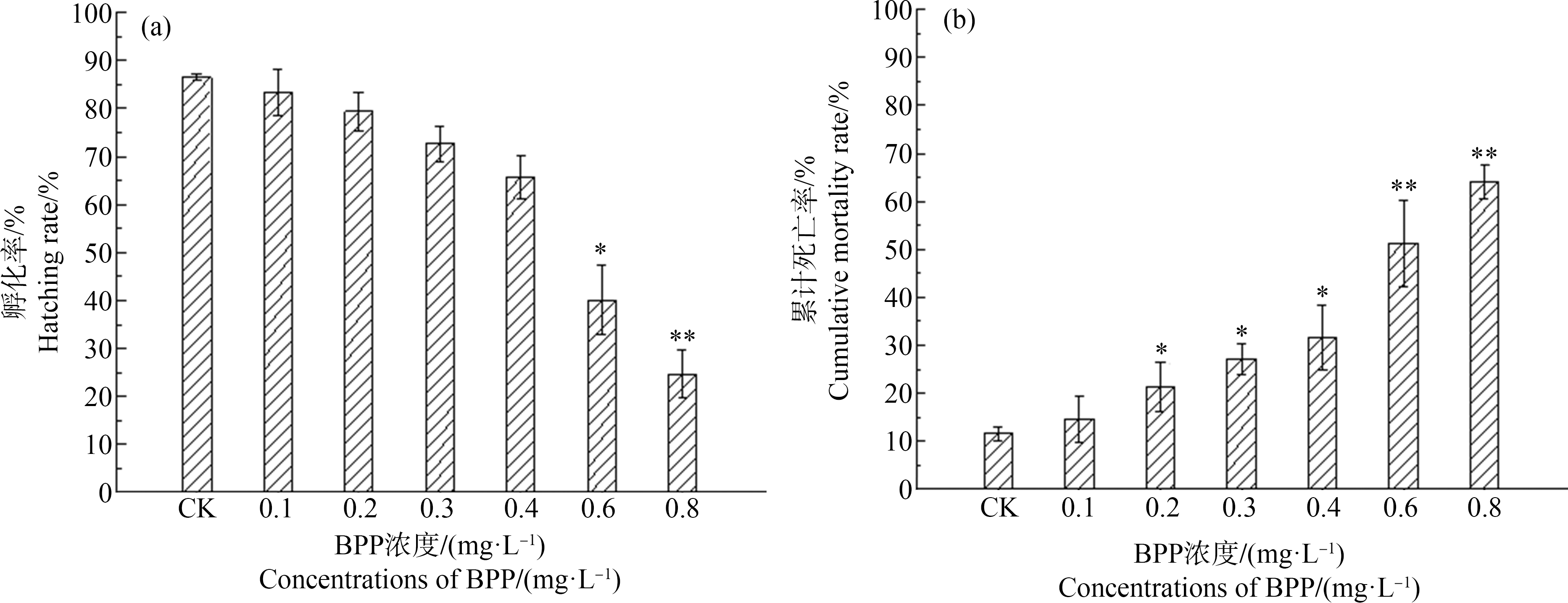
图1 双酚P(BPP)对7 dpf斑马鱼胚胎孵化率(a)和8 dpf斑马鱼累积死亡率(b)的影响
Fig. 1 Hatching rates of 7 dpf embryos (a) and cumulative mortality rates of 8 dpf embryo (b) of zebrafish after exposure to bisphenol P (BPP)
BPP暴露导致斑马鱼出现了心包水肿、卵黄囊肿、脊柱弯曲和尾部弯曲等畸形情况。对30 dpf时畸形斑马鱼的统计结果如图2所示,与孵化率、死亡率相似,BPP对斑马鱼畸形率的影响也具有浓度依赖性,随着暴露浓度的升高,畸形率不断上升。与空白对照组相比,BPP浓度为0.1 mg·L-1时即具有显著性差异(P<0.05),畸形率为17.84%;在0.2 mg·L-1及以上浓度时,畸形率均显著性升高(P<0.01)。在浓度为0.6 mg·L-1时,累积畸形率达到58%,而暴露在浓度为0.8 mg·L-1的BPP溶液的斑马鱼在30 dpf前已经全部死亡,因此未统计总畸形率。
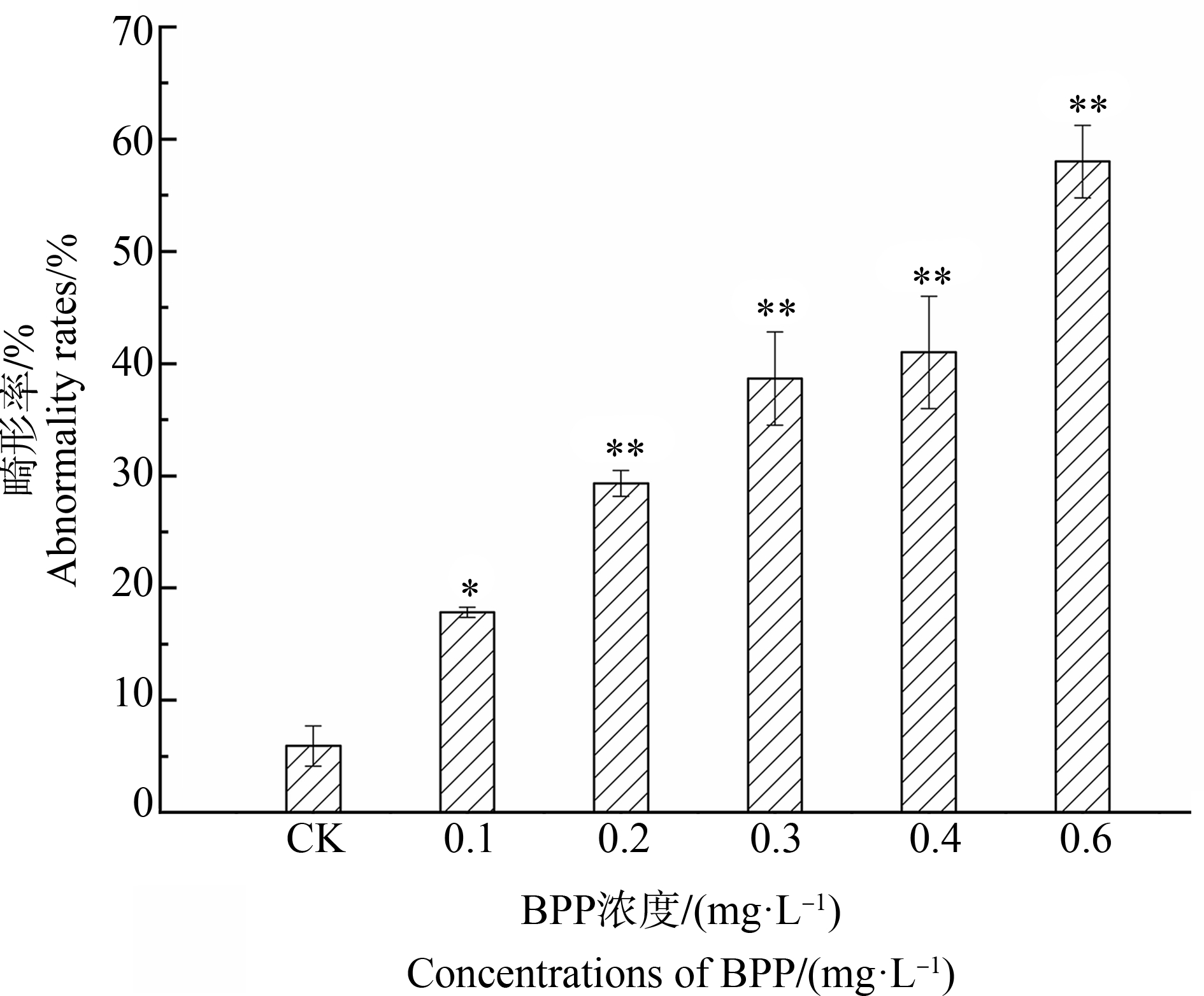
图2 BPP对30 dpf斑马鱼畸形率的影响
Fig. 2 Abnormality rates of 30 dpf zebrafish after exposure to BBP
在30 dpf,从每个处理组中随机选取20条幼鱼进行体质量和体长的测定,结果如图3所示。BPP对斑马鱼的体质量和体长发育具有抑制作用,并且随着浓度的升高,其下降趋势愈加明显。在空白对照组中,斑马鱼的平均体长为1.47 cm,体质量0.05 g,当BPP浓度高于0.3 mg·L-1时,体质量和体长均显著性降低(P<0.05),而0.6 mg·L-1 BPP导致斑马鱼体质量显著下降(P<0.01)。

图3 BPP对30 dpf斑马鱼幼体生长的毒性效应
Fig. 3 Effects of BBP on the larval growth of 30 dpf zebrafish
BPP对斑马鱼7 dpf孵化率、8 dpf累积死亡率、30 dpf畸形率、30 dpf体长抑制、30 dpf体质量抑制的NOEC、LOEC、EC10、EC30和EC50如表1所示。BPP对畸形率的EC50值为0.247 mg·L-1,对30 dpf体质量抑制的EC50值为0.38 mg·L-1,相较与其他生长发育指标更加敏感。
表1 BBP对斑马鱼早期生活阶段毒性效应
Table 1 Toxicity effects of BBP on the early-life stage of zebrafish (mg·L-1)

最大无影响浓度(NOEC)No observed effect concentration (NOEC)最低有影响浓度(LOEC)Lowest observed effect concentration (LOEC)10%效应浓度(EC10)Concentration for 10% of maximal effect (EC10)30%效应浓度(EC30)Concentration for 30% of maximaleffect (EC30)半数效应浓度(EC50)Concentration for 50% of maximal effect (EC50)7 dpf孵化率7 dpf hatching rates0.40.60.2160.3880.5808 dpf累积死亡率8 dpf cumulative mortality rates 0.20.30.0510.130.24730 dpf畸形率30 dpf abnormality rates<0.10.10.030.130.3830 dpf体长抑制 30 dpf body length inhibition0.20.30.1690.476>0.630 dpf体质量抑制30 dpf body weight inhibition0.10.20.1140.3050.6
2.2 BPP对斑马鱼幼体生长阶段的毒性效应
累积暴露60 d后,BPP对斑马鱼“假定”特定生长率(SGR)的影响如图4所示。结果表明,SGR与浓度存在显著的剂量-效应关系,随着BPP浓度的升高,假定特定生长率也随之降低。斑马鱼30~45 d体质量特定生长率(SGR体质量)变化情况如图4(a)所示,0.1、0.2、0.3和0.4 mg·L-1 BPP暴露下,SGR体质量的差异均不显著(P>0.05);BPP为0.6 mg·L-1时,斑马鱼30~45 d SGR体质量与空白对照组(SGR体质量=3.34%)相比显著下降至1.44%(P<0.01)。斑马鱼45~60 d体质量特定生长率变化情况如图4(b)所示,BPP在0.1、0.2和0.3 mg·L-1浓度下差异均不显著(P>0.05),而0.4 mg·L-1和0.6 mg·L-1 BPP暴露后,斑马鱼45~60 d SGR体质量与空白对照组(SGR体质量=2.26%)相比显著下降至1.73%和1.74%(P<0.05)。斑马鱼30~45 d体长特定生长率(SGR体长)变化趋势如图4(c)所示,在0.1、0.2、0.3和0.4 mg·L-1 BPP暴露对SGR体长无显著性影响(P>0.05),当浓度达到0.6 mg·L-1时,斑马鱼30~45 d SGR体长与空白对照组(SGR体长=1.73%)相比显著下降至1.31%(P<0.05)。斑马鱼45~60 d体长特定生长率变化趋势如图4(d),BPP暴露浓度为0.2、0.3和0.4 mg·L-1时,斑马鱼45~60 d SGR体长与对照组(SGR体长=0.55%)相比分别下降至0.39%、0.38%和0.38%(P<0.05);而BPP浓度在0.6 mg·L-1时,SGR体长显著下降至0.28%(P<0.01)。
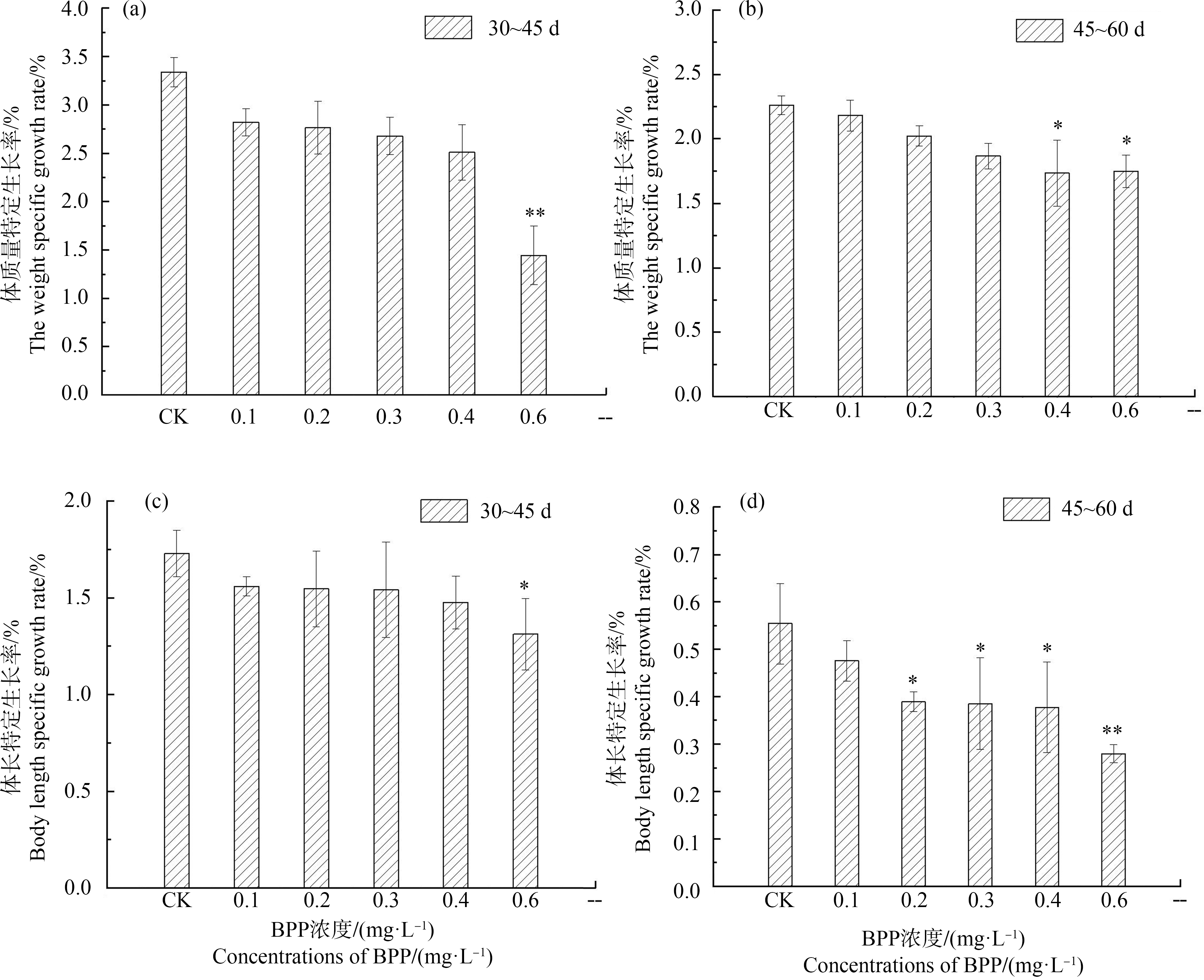
图4 BPP对30 dpf斑马鱼幼体生长的毒性效应
Fig. 4 Effects of BBP on the larval growth of 30 dpf zebrafish
2.3 BPP对斑马鱼激素水平的影响
经过酶联免疫检测(ELISA),BPP对斑马鱼雄鱼体内睾酮(T)、雌二醇(E2)和VTG水平的影响如图5所示。随着BPP暴露浓度的升高,雄鱼体内的睾酮含量不断降低(图5(a))。经统计分析可知,与空白对照组相比,0.1 mg·L-1的BPP将睾酮水平降低了20.91%(P<0.05),而0.2、0.3和0.4 mg·L-1 BPP使雄鱼体内睾酮含量分别降低了33.80%、53.08%和66.18%(P<0.01)。BPP对雄鱼体内雌二醇水平的影响如图5(b),BPP能够提高雄鱼体内雌二醇的水平,并呈现剂量-效应关系。当BPP浓度为0.1 mg·L-1时,雌二醇水平比空白对照组升高了34.17%(P<0.05);BPP浓度高达0.2、0.3和0.4 mg·L-1时,雌二醇水平分别升高了103.22%、117.38%和149.54%,与对照组相比具有显著性差异(P<0.01)。睾酮和雌二醇水平的改变最终导致了睾酮与雌二醇比值的显著性降低(图5(c))。0.1、0.2、0.3和0.4 mg·L-1 BPP的暴露,分别将T/E2降低了40.98%(P<0.05)、67.35%(P<0.01)、78.34%(P<0.01)和86.38%(P<0.01),说明BPP暴露扰乱了斑马鱼体内性激素的平衡。
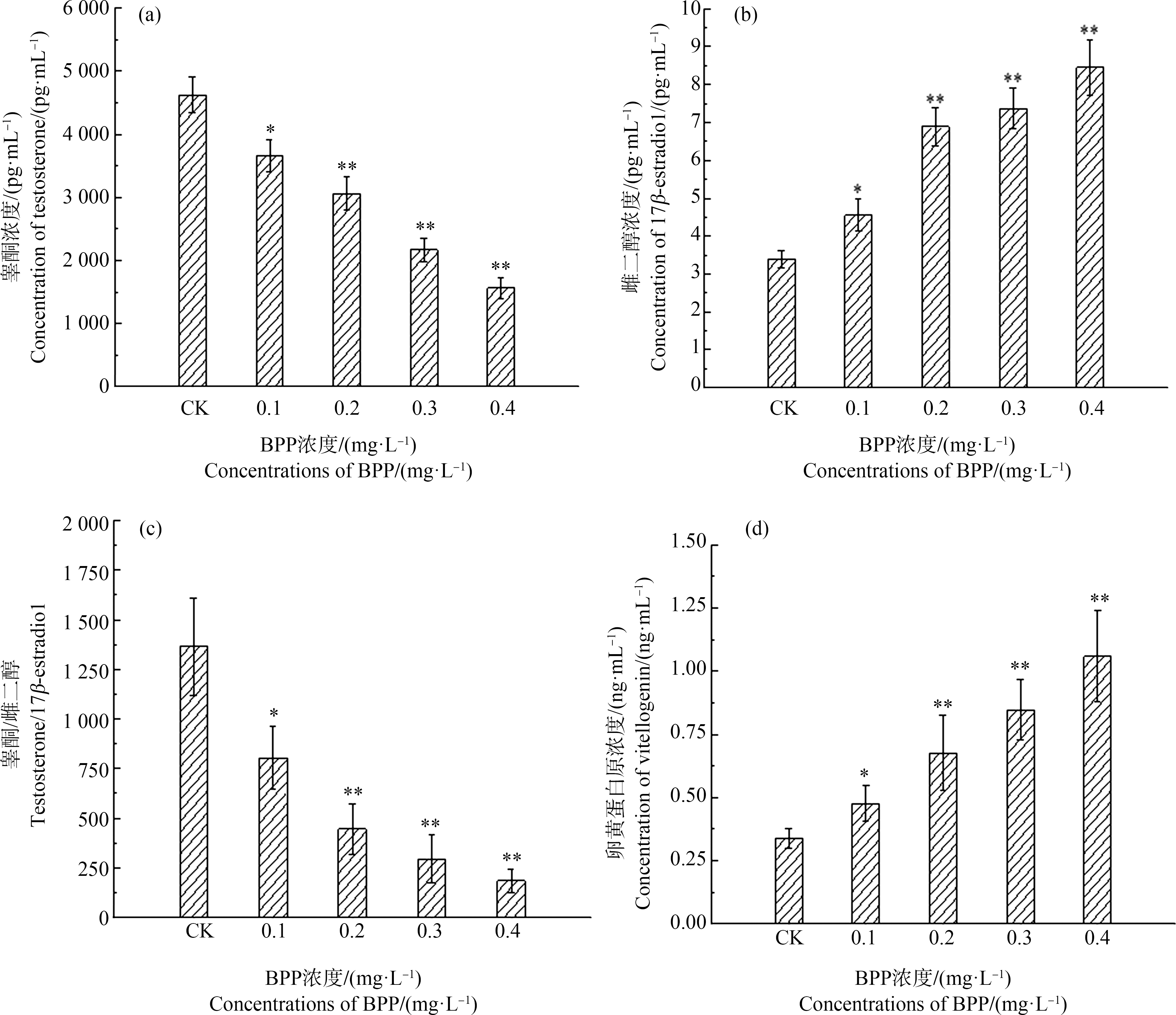
图5 BPP对雄性斑马鱼性激素和VTG水平的影响
Fig. 5 Effects of BPP on sex hormone and VTG levels of male zebrafish
BPP对斑马鱼雄鱼卵黄蛋白原水平的影响如图5(d)所示。随着暴露浓度的升高,VTG的水平呈上升趋势。0.1 mg·L-1的BPP导致VTG水平升高了40.53%(P<0.05);而0.2、0.3和0.4 mg·L-1 BPP使VTG水平分别升高了100.88%、150.30%和213.18%,与空白对照组相比具有显著性差异(P<0.01)。
3 讨论(Discussion)
BPP是一种BPA替代物,随着BPP使用量的增多,可能蓄积于环境和食品介质中,进而对生态和人类健康造成威胁。本研究发现,BPP对斑马鱼从胚胎期开始暴露直至60 dpf,对斑马鱼的孵化率、累积死亡率、畸形率和特定生长率等都产生了不利的影响,并且其毒性效应与暴露剂量和暴露时间有密切的相关性。此外,BPP还能够扰乱斑马鱼体内性激素的平衡,降低睾酮的水平,提高雌二醇的浓度,并提高卵黄蛋白原的水平,我们推测BPP可能会通过性腺轴的干扰作用对斑马鱼的生长发育产生影响。
从实验结果可知,0.6 mg·L-1和0.8 mg·L-1的BPP暴露能够导致斑马鱼胚胎孵化率的显著性降低(图1)。胚胎孵化后,在8 dpf时,BPP暴露导致斑马鱼仔鱼死亡率急剧升高,并且呈现出一定的剂量-效应关系,0.2 mg·L-1的BPP暴露后即与空白对照组出现显著性差异,而在0.6 mg·L-1和0.8 mg·L-1时死亡率显著性升高(图2),可能的原因是在胚胎孵化前,卵膜能够限制BPP的通过,对胚胎具有屏障和保护作用[17-18],也进一步说明仔鱼比胚胎对BPP的暴露更加敏感。多种BPA类似物被报道能够降低斑马鱼胚胎的孵化率和存活率[19-20],说明BPA类似物对鱼类早期生命阶段具有一定的发育毒性效应。由表1可知,BPP对胚胎8 d死亡率的LC50值为0.247 mg·L-1,说明BPP对斑马鱼胚胎和仔鱼的毒性较强,在运输、使用和包装物处置过程中,应该采取有效的防范措施,避免其大量进入水体后对鱼类的生存造成威胁。
在30 dpf,对斑马鱼的总畸形率进行统计,发现BPP对畸形率的影响具有剂量-效应关系。在暴露期间观察到斑马鱼出现了心包水肿、卵黄囊肿、脊柱弯曲和尾部弯曲等畸形情况,这些形态变化在许多外源性污染物对斑马鱼暴露后均会出现,包括其他BPA类似物[21-23]、杀菌剂[24]和药物[25]等,可能与鱼类的多种生理功能受到影响相关,比如氧化应激、细胞凋亡等[26-27],但是BPP对斑马鱼生长发育影响的具体作用机制还需要进一步研究。同样,BPP对斑马鱼体质量、体长的发育也具有抑制作用,不同程度地降低了斑马鱼在30~45 d和45~60 d的特定生长率(图4)。鱼类的特定生长率是其能量收支综合结果的体现,BPP导致的畸形情况是导致斑马鱼生长发育受到抑制的一个重要原因,脊柱弯曲、尾部弯曲可直接导致斑马鱼体长的缩短,并影响斑马鱼的游泳能力,导致无法顺利摄食或缺氧;而心包水肿、卵黄囊肿可能会影响鱼的摄食能力及体内的能量供应、体液循环、内脏器官的发育以及代谢活动等,进而影响斑马鱼的发育,导致体质量和体长的降低[28-30]。
从BPP对斑马鱼7 d-孵化率、8 d-累积死亡率、30 d-畸形率、体长及体质量抑制的NOEC、LOEC、EC10、EC30和EC50值可知,在胚胎和仔鱼阶段,BPP对斑马鱼的8 d-累积死亡率的NOEC值和EC50值均较低,说明8 d-累积死亡率可以作为评价外源污染物对斑马鱼生命早期阶段急性毒性效应的敏感性指标。在暴露30 d,BPP对畸形率和体质量抑制的NOEC值(≤0.1 mg·L-1)与体长抑制NOEC值相比更加敏感,说明对于生命早期阶段的慢性暴露,畸形率和体质量可以作为敏感性指标进行毒性评价。在幼体发育阶段,45~60 d期间BPP对斑马鱼体长和体质量影响的效应浓度更低,说明慢性暴露下BPP对机体的累积损伤更加严重。
BPA是一种典型的内分泌干扰物,会干扰雄性生殖器官的发育,阻断精子的形成和成熟,扰乱激素平衡,影响雄性生殖能力等[31-32]。BPA类似物的结构与BPA类似,因此可能对生物系统产生同样的毒性效应,大量的研究表明,BPF、BPS和BPAF等BPA类似物也具有与BPA相似甚至更强的内分泌干扰效应[33-34]。Wang等[11]的研究表明,BPP对摇蚊的暴露改变了胚胎的孵化率、幼虫的羽化率和成虫的性别比例,显示对摇蚊的出内分泌干扰效应。本研究发现,BPP浓度低至0.1 mg·L-1时即可显著降低斑马鱼雄鱼体内雄激素的水平,升高雌激素水平,破坏性激素的平衡,说明BPP对斑马鱼具有较强的内分泌干扰效应。性激素水平在鱼类生长发育和繁殖中起关键作用,因此,BPP暴露后引起的性激素水平紊乱可能是影响斑马鱼生长发育的一个重要原因。类似的结果也出现在其他类似物对斑马鱼的暴露过程中,BPS[35]、BPF[36]和BPB[37]都被报道能够扰乱斑马鱼的性激素水平,并对幼体的生长发育造成损伤。在成熟的雌鱼体内,卵黄蛋白原是在内源性雌二醇的作用下,在肝脏中产生的一种卵黄蛋白前体。而在雄鱼和幼鱼的体内,没有或仅有微量的VTG存在,很难被检测到。但外源性雌激素的存在能够诱导雄鱼和幼鱼的肝脏合成VTG,因此卵黄蛋白原可以作为检测外源性雌激素的生物标志物。Mu等[38]的研究表明,BPAF、BPA和BPF均可显著提高斑马鱼胚胎中vtg1的基因表达水平。Le Fol等[39]使用0.1 μmol·L-1和1 μmol·L-1的BPF对6月龄雄性斑马鱼进行7 d的暴露,发现BPF能够显著诱导斑马鱼体内卵黄蛋白原的合成。杨倩等[40]将斑马鱼成鱼暴露于BPAF、BPAP、BPB、BPF、BPS和BPZ这6种BPA类物质21 d后,发现这6种物质均可不同程度地提高斑马鱼雄鱼的卵黄蛋白原水平。在本研究中,BPP暴露后,斑马鱼匀浆液中的VTG水平也显著性升高,表明BPP可能对斑马鱼具有潜在的雌激素效应。我们推测,一方面,BPP与雌二醇具有相似的结构,容易与雌激素受体结合诱导VTG的合成;另一方面,BPP暴露后提高了斑马鱼雄鱼体内的雌激素水平,并进一步促进了VTG的合成,导致VTG水平显著性升高,因此,本研究中VTG水平的升高可能是BPP及升高的雌激素水平共同作用的结果。
综上所述,0.6 mg·L-1和0.8 mg·L-1的BPP对斑马鱼胚胎进行暴露后,导致胚胎的7 d-孵化率显著性降低;而0.2 mg·L-1以上浓度BPP即可导致斑马鱼8 d-死亡率的显著性升高,说明8 d-死亡率是更加敏感的生理指标。暴露30 d时,0.1 mg·L-1以上浓度的BPP暴露均导致斑马鱼的畸形率显著性升高,发育异常现象可能进一步抑制了斑马鱼体质量和体长的生长,导致斑马鱼的30 d体质量和体长、30~45 d与45~60 d的体质量和体长增长率均呈现显著性降低。暴露60 d后,0.1 mg·L-1及以上浓度的BPP能够导致斑马鱼雄鱼体内雌激素水平显著性升高,雄激素水平显著性降低,并且可以促进卵黄蛋白原的合成,这可能是影响斑马鱼生长发育的原因之一,具体的作用机制将进行进一步的研究。
本研究发现,BPP的长期慢性暴露对斑马鱼的胚胎和幼体的生长发育具有较强的毒性效应。但是本研究的浓度设置高于实际环境浓度,在接下来的研究中,我们将继续开展低剂量的慢性暴露实验,进一步探究BPP对斑马鱼的毒性效应及作用机制,以期为BPP的生态安全性评价提供科学的依据。
[1] Chen D, Kannan K, Tan H L, et al. Bisphenol analogues other than BPA: Environmental occurrence, human exposure, and toxicity—A review [J]. Environmental Science & Technology, 2016, 50(11): 5438-5453
[2] Yamazaki E, Yamashita N, Taniyasu S, et al. Bisphenol A and other bisphenol analogues including BPS and BPF in surface water samples from Japan, China, Korea and India [J]. Ecotoxicology and Environmental Safety, 2015, 122: 565-572
[3] Liao C Y, Kannan K. Concentrations and profiles of bisphenol A and other bisphenol analogues in foodstuffs from the United States and their implications for human exposure [J]. Journal of Agricultural and Food Chemistry, 2013, 61(19): 4655-4662
[4] Morgan M K, Clifton M S. Exposure to triclosan and bisphenol analogues B, F, P, S and Z in repeated duplicate-diet solid food samples of adults [J]. Toxics, 2021, 9(3): 47
[5] Li A J, Zhuang T F, Shi W, et al. Serum concentration of bisphenol analogues in pregnant women in China [J]. The Science of the Total Environment, 2020, 707: 136100
[6] Zhang H, Quan Q, Zhang M Y, et al. Occurrence of bisphenol A and its alternatives in paired urine and indoor dust from Chinese university students: Implications for human exposure [J]. Chemosphere, 2020, 247: 125987
[7] Liu J C, Zhang L Y, Lu G H, et al. Occurrence, toxicity and ecological risk of bisphenol A analogues in aquatic environment—A review [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111481
[8] 任文娟, 汪贞, 杨先海, 等. 双酚A及其类似物对斑马鱼成鱼及胚胎的急性毒性[J]. 生态与农村环境学报, 2017, 33(4): 372-378
Ren W J, Wang Z, Yang X H, et al. Acute toxicity effect of bisphenol A and its analogues on adult and embryo of zebrafish [J]. Journal of Ecology and Rural Environment, 2017, 33(4): 372-378 (in Chinese)
[9] Lee S, Liu X S, Takeda S, et al. Genotoxic potentials and related mechanisms of bisphenol A and other bisphenol compounds: A comparison study employing chicken DT40 cells [J]. Chemosphere, 2013, 93(2): 434-440
[10] Rosenmai A K, Dybdahl M, Pedersen M, et al. Are structural analogues to bisphenol A safe alternatives? [J]. Toxicological Sciences, 2014, 139(1): 35-47
[11] Wang L, Zhou L J, Fan D L, et al. Bisphenol P activates hormonal genes and introduces developmental outcomes in Chironomus tentans [J]. Ecotoxicology and Environmental Safety, 2019, 174: 675-682
[12] Ike M, Chen M Y, Danzl E, et al. Biodegradation of a variety of bisphenols under aerobic and anaerobic conditions [J]. Water Science and Technology: A Journal of the International Association on Water Pollution Research, 2006, 53(6): 153-159
[13] Danzl E, Sei K, Soda S, et al. Biodegradation of bisphenol A, bisphenol F and bisphenol S in seawater [J]. International Journal of Environmental Research and Public Health, 2009, 6(4): 1472-1484
[14] Arnot J A, Gobas F A. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms [J]. Environmental Reviews, 2006, 14(4): 257-297
[15] Organisation for Economic Co-operation and Development (OECD). Guideline for the testing of chemicals, 210 fish, early-life stage toxicity test [S]. Paris: OECD, 2000
[16] Organisation for Economic Co-operation and Development (OECD). Test No. 215: Fish, juvenile growth test [R]. Paris: OECD, 2000
[17] 王雪, 王希敏, 刘可春, 等. 斑马鱼胚胎在毒理学研究中的应用[J]. 山东科学, 2011, 24(6): 49-52
Wang X, Wang X M, Liu K C, et al. Application of zebrafish embryo in toxicology [J]. Shandong Science, 2011, 24(6): 49-52 (in Chinese)
[18] Panzica-Kelly J M, Zhang C X, Augustine-Rauch K A. Optimization and performance assessment of the chorion-off [dechorinated] zebrafish developmental toxicity assay [J]. Toxicological Sciences, 2015, 146(1): 127-134
[19] Shi J C, Jiao Z H, Zheng S, et al. Long-term effects of bisphenol AF (BPAF) on hormonal balance and genes of hypothalamus-pituitary-gonad axis and liver of zebrafish (Danio rerio), and the impact on offspring [J]. Chemosphere, 2015, 128: 252-257
[20] Yang Q, Yang X H, Liu J N, et al. Effects of BPF on steroid hormone homeostasis and gene expression in the hypothalamic-pituitary-gonadal axis of zebrafish [J]. Environmental Science and Pollution Research, 2017, 24(26): 21311-21322
[21] Duan Z H, Zhu L, Zhu L Y, et al. Individual and joint toxic effects of pentachlorophenol and bisphenol A on the development of zebrafish (Danio rerio) embryo [J]. Ecotoxicology and Environmental Safety, 2008, 71(3): 774-780
[22] Yang Q, Yang X H, Liu J N, et al. Effects of exposure to BPF on development and sexual differentiation during early life stages of zebrafish (Danio rerio) [J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology: CBP, 2018, 210: 44-56
[23] Song M Y, Liang D, Liang Y, et al. Assessing developmental toxicity and estrogenic activity of halogenated bisphenol A on zebrafish (Danio rerio) [J]. Chemosphere, 2014, 112: 275-281
[24] Pang S, Guo M C, Zhang X, et al. Myclobutanil developmental toxicity, bioconcentration and sex specific response in cholesterol in zebrafish (Danio rerio) [J]. Chemosphere, 2020, 242: 125209
[25] Liang X M, Wang F, Li K B, et al. Effects of norfloxacin nicotinate on the early life stage of zebrafish (Danio rerio): Developmental toxicity, oxidative stress and immunotoxicity [J]. Fish & Shellfish Immunology, 2020, 96: 262-269
[26] Chen G L, Wang L P, Li W P, et al. Nodularin induced oxidative stress contributes to developmental toxicity in zebrafish embryos [J]. Ecotoxicology and Environmental Safety, 2020, 194: 110444
[27] Jin H M, Ji C, Ren F, et al. AHR-mediated oxidative stress contributes to the cardiac developmental toxicity of trichloroethylene in zebrafish embryos [J]. Journal of Hazardous Materials, 2020, 385: 121521
[28] Tu W Q, Niu L L, Liu W P, et al. Embryonic exposure to butachlor in zebrafish (Danio rerio): Endocrine disruption, developmental toxicity and immunotoxicity [J]. Ecotoxicology and Environmental Safety, 2013, 89: 189-195
[29] Yao H Z, Yu J P, Zhou Y, et al. The embryonic developmental effect of sedaxane on zebrafish (Danio rerio) [J]. Chemosphere, 2018, 197: 299-305
[30] Pelka K E, Henn K, Keck A, et al. Size does matter—Determination of the critical molecular size for the uptake of chemicals across the chorion of zebrafish (Danio rerio) embryos [J]. Aquatic Toxicology, 2017, 185: 1-10
[31] Liu J C, Zhang L Y, Lu G H, et al. Occurrence, toxicity and ecological risk of bisphenol A analogues in aquatic environment—A review [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111481
[32] Goldstein K M, Seyler D E, Durand P, et al. Use of a rat ex-vivo testis culture method to assess toxicity of select known male reproductive toxicants [J]. Reproductive Toxicology, 2016, 60: 92-103
[33] Siracusa J S, Yin L, Measel E, et al. Effects of bisphenol A and its analogs on reproductive health: A mini review [J]. Reproductive Toxicology, 2018, 79: 96-123
[34] Adegoke E O, Rahman M S, Pang M G. Bisphenols threaten male reproductive health via testicular cells [J]. Frontiers in Endocrinology, 2020, 11: 624
[35] Naderi M, Wong M Y, Gholami F. Developmental exposure of zebrafish (Danio rerio) to bisphenol-S impairs subsequent reproduction potential and hormonal balance in adults [J]. Aquatic Toxicology, 2014, 148: 195-203
[36] Yang Q, Yang X H, Liu J N, et al. Effects of BPF on steroid hormone homeostasis and gene expression in the hypothalamic-pituitary-gonadal axis of zebrafish [J]. Environmental Science and Pollution Research, 2017, 24(26): 21311-21322
[37] Yang Q, Zhu Z Z, Liu Q, et al. Adverse effects of bisphenol B exposure on the thyroid and nervous system in early life stages of zebrafish [J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology: CBP, 2021, 250: 109167
[38] Mu X Y, Huang Y, Li X X, et al. Developmental effects and estrogenicity of bisphenol A alternatives in a zebrafish embryo model [J]. Environmental Science & Technology, 2018, 52(5): 3222-3231
[39] Le Fol V, Aït-Aïssa S, Sonavane M, et al. In vitro and in vivo estrogenic activity of BPA, BPF and BPS in zebrafish-specific assays [J]. Ecotoxicology and Environmental Safety, 2017, 142: 150-156
[40] 杨倩, 杨先海, 刘济宁, 等. 双酚A替代物对雄性斑马鱼性激素及卵黄蛋白原水平的影响[J]. 南京工业大学学报: 自然科学版, 2018, 40(5): 6-13
Yang Q, Yang X H, Liu J N, et al. Effects of bisphenol A and its substitutes on levels of steroid hormone and vitellogenin in adult male zebrafish [J]. Journal of Nanjing Tech University: Natural Science Edition, 2018, 40(5): 6-13 (in Chinese)