化学物质引起的人体肝脏疾病不容忽视。肝脏在保护机体免受有毒有害化学物质侵害方面发挥着重要作用,它能够将亲脂性物质转化为更多的水溶性代谢物,并通过尿液有效地从体内排出[1]。然而,一些化学物质仍然会引起以炎症、氧化应激和坏死为特征的肝脏损害[2]。据统计,超过50%以上的肝脏损害临床案例是由于药物引起的,并且研究发现,在过去的20年里,导致肝脏损害的化学物质还包括工业化学品、生物杀虫剂、化妆品成分、食品添加剂和膳食补充剂等多类型化学物质[3]。如今,全球每年新增化学物质的数量超过1 000种[4],这些化学物质在生产和使用过程中可能会产生环境污染,从而对生活在这样环境中的人群的健康,特别是肝脏,产生不良的影响。为了保护人体健康免受某些环境化学物质的危害,利用肝毒性测试模型开展环境化学物质肝毒性预测和评估是识别健康危害的重要方面之一。
化学物质肝毒性测试方法包括传统的动物模型(以啮齿类为代表)和体外细胞模型。动物模型可以从组织以及个体水平上反映对环境化学物质暴露的生物效应,但是在面对大量待测环境化学物质的挑战以及物种间差异问题时存在一定的局限性。2007年由美国国家研究委员会提出的“21世纪毒理学测试远景与策略”强调未来毒性测试方法的重心将从整体动物的系统测试转向基于毒性通路和毒性作用机制的体外测试,因此,以人源细胞系或者细胞成分为主的体外测试模型在评估环境化学物质的人体肝毒性方面发挥着越来越重要的作用[3]。经典的二维(2D)单层培养系统因为操作简单而被广泛用于化学物质高通量毒性测试,但是越来越多的研究发现在2D单层培养中,维持细胞生理表型所需的生化反应和细胞间的相互作用会随着培养时间延长而逐渐消失,尤其是在肝细胞中发挥重要作用的各种代谢或转运酶的表达量会降低[5];并且在此培养模型下得到的环境化学物质毒性评估无法很好地反映生物体内长期重复剂量暴露下的真实毒性效应[6]。因此,为了提高基于体外预测模型的环境化学物质毒性预测准确性,建立能够模拟体内环境的体外测试模型是非常重要的。
三维(3D)体外细胞培养模型在环境化学物质肝毒性测试方面,为更真实地反映环境化学物质诱发人体肝毒性效应及揭示致毒机制提供了新的测试平台。3D体外细胞培养不同于传统的2D单层贴壁细胞培养方式,细胞在表面黏附能力极低或含有细胞基质的支架中培养,并利用天然的细胞间相互作用来驱动3D结构的形成,这使得即使肝细胞在体外经历长时间(例如28 d)培养,其功能也能得到较完整的保留,并且细胞也能以类似活体组织的微组织形态存在[7]。3D体外细胞培养起初是用于药物毒性测试和筛选,随着研究的深入,药物肝毒性预测准确率不断提高[8]。目前随着社会对环境化学物质毒性的关注越来越密切,3D体外细胞培养模型在环境化学物质肝毒性预测方面的应用也在不断增加[9]。但是,大部分现有的研究依然是从细胞毒性或者基因表达等细胞和分子层面评估环境化学物的肝毒性,如何充分发挥3D体外细胞培养模型的优势,为环境化学物质肝毒性研究提供系统的毒性机制信息是未来研究的挑战。与此同时,有害结局路径(adverse outcome pathway, AOP)框架很好地总结了驱动毒性发生的致毒机制,整合了从分子、细胞、器官乃至个体、种群水平的各个毒性事件[10]。毒性事件按发生的时间顺序可以分为分子起始事件(molecular initiating event, MIE),关键事件(key events, KEs)和有害结局(adverse outcomes, AOs)[10]。框架化的毒性机制为体外测试方法的应用提供了理论基础[11]。创立于2014年的AOP-wiki数据库(https://aopwiki.org/)目前(截至2021年8月31日)有22条与肝毒性相关的AOPs,涉及的肝毒性终点包括肝脏肿瘤、肝纤维化、脂肪肝、胆汁淤积以及肝细胞损伤。驱动肝毒性发生的致毒机制总结为3D体外肝细胞培养方法的建立以及测试应用提供了机制参考信息。本文综述了目前常用3D体外细胞培养模型的制备方法,以及在环境化学物质(纳米材料、持久性有机污染物和新型有机污染物等)肝毒性预测方面的应用,最后探讨了3D肝细胞体外培养模型在AOP指导下开展肝毒性预测的研究现状与应用前景,包括如何确定细胞培养体系和整合毒性测试信息、如何提高环境化学物质肝毒性预测的效率以及准确性等。
1 3D体外培养模型的制备方法(Methods of 3D in vitro culture models)
依据制备方法,3D肝细胞体外培养模型可以分为夹层培养法、静态球形模型、生物反应器、器官芯片和3D生物打印(表1)。
1.1 夹层培养法
肝细胞夹层培养法被广泛应用于化学物质通过胆汁淤积诱导的肝毒性研究中。它的培养方式是在2层细胞外基质之间培养肝细胞(图1(a))。通常用到的细胞外基质是凝胶的胶原蛋白或Matrigel(一种细胞外基质的混合物,其中包含层连蛋白和多种生长因子);细胞外基质的构成影响着细胞的排列和功能,夹层培养中的底层基质先于细胞放置于培养板中,故基质种类和成分的不同会影响底层基质的硬度以及粘连蛋白的数量从而影响后续接种细胞形态和多细胞排列;覆盖层基质放入后,细胞会处于上下覆盖的立体空间中,这样的环境有利于维持细胞的活力,并能诱导细胞分化,影响胆汁的分泌和排泄行为[12, 17]。肝细胞在夹层培养中保存了肝细胞极性,以及胆管功能的形成。这种3D肝细胞培养系统可用于评估化学物质对肝胆运输的影响以及化学物质引起由胆汁酸介导的肝脏毒性(胆汁淤积)[17]。Chatterjee等[18]利用夹层培养法分别构建了基于人源肝细胞和大鼠源肝细胞的化学物质胆汁淤积评估模型,通过比较不同模型下得到的化学物质胆汁淤积指数,该研究发现人源肝细胞模型中获得的胆汁淤积指数与报道的临床药物胆汁淤积发生率相关。同时,另一则研究利用该培养方式对344个药物的肝毒性进行测试,并实现了50%~60%的真阳性预测准确率[19]。然而,夹层培养法的主要局限性是在长期培养中存在渗漏、胆管损伤和胆汁淤积的现象,因此夹层培养法的培养条件还需要改善,以便增加体外模拟肝胆排泄过程所需的胆管系统的稳定性[20]。
1.2 静态球形模型
球形模型是指那些使细胞聚集为细胞球状体的细胞培养体系,其中悬滴培养法和微模法是2种比较常用的静态球形模型,因为操作简单而被广泛应用于化学物质肝毒性评估以及机制研究中(图1(b))。HepG2(人肝癌细胞)球状体和HepaRG(末分化的人肝癌细胞)球状体是2种在静态球形模型下容易获取的肝细胞球状体。HepG2球状体相比于常规的2D培养方式下的HepG2具有较好的糖原储存和代谢能力,且白蛋白、尿素、异源物质转录因子、Ⅰ相和Ⅱ相代谢酶表达量增多[13]。分化状态下的HepaRG细胞的酶活性以及转录组表达情况与原代人肝细胞相似,它被认为是原代人源肝细胞的替代细胞系[21]。但是在2D单层培养下,HepaRG的部分细胞色素酶、Ⅱ相酶以及转运蛋白表达量与原代人源细胞相比显著下降[22]。HepaRG球状体可培养长达4周且在培养过程中外源代谢能力一直保持着与原代人肝细胞相似的水平[23]。研究表明HepG2和HepaRG球状体有着不同的应用场景,HepG2球状体在识别化学物质引起的细胞毒性方面有着更高的敏感性,而HepaRG球状体在分子水平识别特异毒性方面有着更好的能力[24-25]。
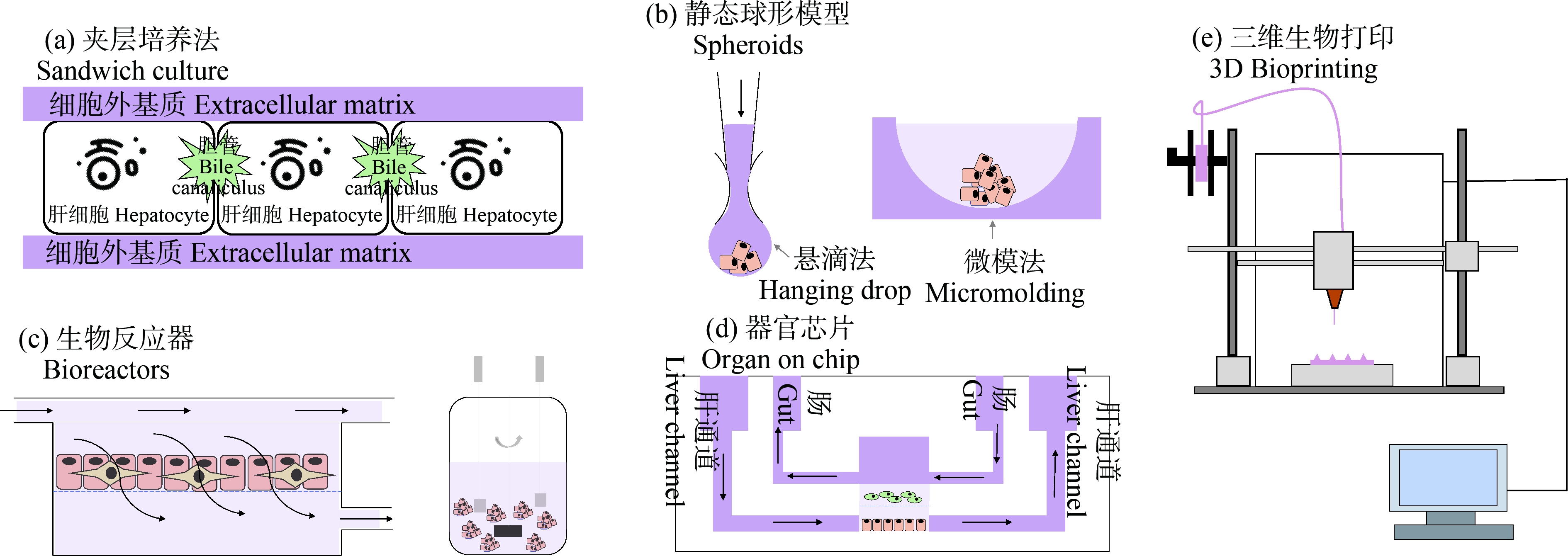
图1 3D体外培养模型制备方法
Fig. 1 Methods of 3D in vitro culture models
表1 3D体外培养模型的制备方法
Table 1 Methods of 3D in vitro culture models

3D培养方法3D generation methods肝细胞类型Hepatocytes 培养时间Culture times高通量能力High-throughput支架Scaffold模型特点Comments参考文献References夹层培养Sandwich culture原代肝细胞(人、大鼠、小鼠) Primary hepatocytes (human/rat/mouse)2周2 weeks☆☆Collagen或Matrigel基底胶Collagen/Matrigel一种极化的肝脏体外模型,可以研究药物胆汁分泌、药物处置以及化学物质肝胆毒性A polarized hepatocytes in vitro model that allows studying drug bile secretion, drug disposal, and hepatobiliary toxicity of chemicals[12]静态球形模型3D spheroids原代肝细胞(人、大鼠、小鼠)、HepG2、Hep-aRG、干细胞、肝细胞与非实质细胞共培养Primary hepatocytes (hu-man/rat/mouse), HepG2, HepaRG, stem cells, co-culture with non-pa-renchymal cells (NPCs)>2周>2 weeks☆☆☆无支架Scaffold-free利用细胞自身的自组织特性形成球形聚集,具有可观察的肝功能表型,用于化学物质肝毒性测试以及肝脏疾病的研究By self-organization, hepatocytes form spheroids with observable liver function phenotypes, which can be used for assessing hepato-toxicity of chemicals and stud-ying liver diseases[13]生物反应器Bioreactors原代肝细胞(人、大鼠、小鼠)、HepG2、Hep-aRG、干细胞、肝细胞与非实质细胞共培养Primary hepatocytes (hu-man/rat/mouse), HepG2, HepaRG, stem cells, co-culture with NPCs>2周>2 weeks-合成聚合物Synthetic polymers能够准确监测培养条件,整个系统处于流动状态,模拟肝脏去毒过程,用于体外肝脏支持器,需要大量的细胞,化学物质肝毒性测试通量低The culture conditions can be ac-curately monitored; in a flow-through state, the system can simulate the liver detoxification process, and be used for in vitro liver supporters; it requires large numbers of cells and the through-put for predicting hepatotoxicity of chemicals is low [14]器官芯片Organ on chip原代肝细胞(人、大鼠、小鼠)、HepG2、Hep-aRG、干细胞、肝细胞与非实质细胞共培养、其他器官(肠、肾)细胞共培养Primary hepatocytes (hu-man/rat/mouse), HepG2, HepaRG, stem cells, co-culture with NPCs or kidney/gut cells>2周>2 weeks-无支架Scaffold-free流动的装置能够去除代谢产物,多组织来源的细胞共培养模型模拟了化学物质在体内暴露的真实场景The flowing apparatus can re-move metabolites, and multi-cells co-culture from different tissues mimic the situation of chemicals exposure in vivo[15]

3D培养方法3D generation methods肝细胞类型Hepatocytes 培养时间Culture times高通量能力High-throughput支架Scaffold模型特点Comments参考文献References3D生物打印3D Bioprinting原代肝细胞(人、大鼠、小鼠)、HepG2、Hep-aRG、干细胞、肝细胞与非实质细胞共培养Primary hepatocytes (hu-man/rat/mouse), HepG2, HepaRG, stem cells, co-culture with NPCs>2周>2 weeks☆合成聚合物Synthetic polymers按照预先设定的程序,生物材料能够被精准放置,制备出复杂的生物结构Based on a predetermined proce-dure, biological materials can be precisely placed to generate com-plex biological structures[16]
注:高通量能力中,2D细胞培养为☆☆☆,静态球形模型具有与2D细胞培养一样的通量,夹层培养通量适中,生物反应器与器官芯片无高通量,3D生物打印高通量能力有限。
Note: As for high-throughput, 2D cell culture has ☆☆☆; the high-throughput capability of 3D spheroids is the same with 2D cell culture, with sandwich culture middle-throughput; bioreactors and organ on chip have low-throughput capability; 3D bioprinting has a limited high-throughput capability.
肝非实质细胞在肝毒性产生过程中发挥着重要作用,因此由肝细胞和肝星状细胞、Kupffer细胞、窦状内皮细胞共同培养的多细胞球形模型提高了预测化学物质肝毒性的能力。其中,肝细胞与肝星状细胞共培养比较常见,而组成相对复杂的肝细胞、肝星状细胞与Kupffer细胞的三元共培养系统则可更全面、高效地评估化学物质引发肝纤维化的机制及能力[26]。Prestigiacomo等[27]利用GravityPLUSTM Hanging Drop系统构建了一个由HepaRG、肝星状细胞以及巨噬细胞混合培养的3D肝微组织模型,并证实该模型可以在体外再现导致肝脏纤维化的分子与细胞水平的关键生物事件,如肝细胞损伤、抗氧化反应、Kupffer细胞激活、肝星状细胞激活以及细胞外基质沉积。尽管静态球状模型在高通量化学物质肝毒性预测方面有着较好的应用前景,但是目前的研究往往缺乏统一的测试基准来标准化测试结果,因此限制了其在大规模化学物质肝毒性预测方面的应用。
1.3 生物反应器
生物反应器因培养条件可控的特点为体外细胞培养提供了良好的生长环境,被用于化学物质肝毒性研究。生物反应器是一个通过灌注或者搅拌的方式使肝细胞培养系统处于一个流动状态的装置(图1(c)),该装置将血流动力学和剪切应力对肝脏功能的影响考虑到了模型制备中,目的是为了生成更贴近体内肝脏复杂形态的模型,特别是弥补了严重肝损伤时肝脏功能下降的不足[28]。流动的生物反应器可以提升模型的去毒能力同时保存生物合成和生物转化的功能。最早报道的生物反应器是一个体积为800 mL的3D灌注多室中空纤维膜生物反应器[29],它由3个独立的毛细管系统组成,分别用于动静脉介质灌注、氧气供应和二氧化碳清除,当反应器中接种肝脏实质和非实质细胞后,这些细胞在培养过程中自我组装成组织样结构。之后,该装置被缩小到2 mL的体积,使用的细胞量也减少至1.2×108个,适用于临床药物测试。在该装置内,细胞色素酶P450可保持活性长达23 d,肝实质细胞和非实质细胞的生理结构也能被观察到,管状转运体蛋白MRP2 (multidrug resistance-associated protein 2)、P-gp (P-glycoprotein)和BCRP (breast cancer resistance protein)等外排型转运蛋白分布特征也与人体肝脏组织中的分布特征相似。此外,研究发现HepaRG细胞和原代人肝细胞在生物反应器培养中表现出相似的细胞色素酶P450和尿苷二磷酸葡萄糖醛酸转移酶活性[30]。生物反应器还可以密切监视整个反应介质中氧气、乳酸含量以及任何可通过近红外技术测量的参数;同样的,细胞的状态也可以通过观察细胞内荧光蛋白的含量得到反映[31]。总的来说,生物反应器装置在模拟肝脏的功能和表型方面表现优异,但实际使用过程中由于所需细胞量巨大而不适用于高通量的毒性测试。
1.4 器官芯片
器官芯片为研究化学物质肝毒性提供了一种复杂度更高、仿真效果更好的体外模拟人体肝脏器官的方式[32-33]。模型利用微流控技术将不同类型细胞在同一个系统的分隔室内共同培养,通过产生流体剪切力、机械应力和生化浓度梯度等理化刺激使细胞发生自组装,从而在培养过程中表现出更加真实的生理学功能[33]。肝脏芯片技术为研究药物代谢和化学物质毒性测试提供了一个更加接近于人体真实暴露环境的装置,且肝脏芯片已逐渐被商业化使用[34]。例如,Organovo公司生产了一种由原代肝细胞和非血小板细胞组成的肝脏微组织芯片ExViveTM[35]。Rennert等[36]使用双通道微流控技术创建了一个由多孔膜(模拟肝淋巴间隙)分隔的3D肝脏模型,该模型整合了由内皮细胞和组织巨噬细胞组成的血管层以及由肝星状细胞与HepaRG细胞共同培养的肝脏层,增强了肝细胞的极性,并允许观察肝胆功能。同时,器官芯片还可以通过连接肠道上皮细胞和肝脏细胞形成肝-肠多器官芯片,进一步增加器官芯片的复杂性[37](图1(d)),这样的模型可用于研究化学物质的代谢途径以及在器官水平上评估化学物质的毒性效应。Choe等[15]开发了一种由肠道上皮细胞(Caco-2)和肝细胞(HepG2)2个单独层组成的微流体肠道肝芯片,2种细胞的细胞色素酶P450代谢活性在该培养系统中显著增强,且Caco-2细胞的吸附特性也因流动而改变,在评估药物代谢特征方面比单一细胞培养更接近人体报告数据。总之,肝器官芯片提供了一个更加接近于人体肝脏器官的体外培养模型,有利于准确掌握化学物质引发肝毒性的致毒机制及毒代动力学过程,但是大部分的肝脏器官芯片测试还需要得到进一步的验证,且芯片的高成本阻碍了其应用。
1.5 3D生物打印
3D生物打印利用编程技术可以实现对肝细胞以及细胞外基质的精准组装,被逐渐应用于预测化学物质肝毒性以及毒性机制研究中。这项技术使用含有细胞的生物材料作为生物打印墨水,在预设的计算机程序下,逐层精确定位墨水的空间位置,从而打印出具有生物活性的立体细胞组织构架(图1(e))。3D生物打印的方法策略包括3个方面:(1)仿生学,即对组织或器官的细胞和细胞外成分进行体外复制,复现结构的同时也要保证功能的实现;(2)自组装,即利用胚胎作为生物组织复制的原材料,并通过操纵培养系统的参数来驱动3D生物打印组织中的胚胎生长;(3)微型组织、器官,即利用仿生学和自组装策略的结合,将自我组装的细胞集团,再次组装成为功能性的宏观组织[38]。目前3D生物打印主要有3种打印方式:激光辅助生物打印[39]、液滴喷射生物打印[40]和挤压成型生物打印[41]。通过这些技术,3D生物打印最终能够在体外构建出一个功能性的组织或器官,用于化学物质的毒性预测和筛选。在化学物质肝毒性筛选与预测方面,Ide等[8]利用3D Regenova®生物打印机生成了由原代人肝细胞和人肝星状细胞组成的肝微组织,该微组织直径大约1 mm,能够持续培养25 d,且保持长期的细胞活力以及代谢与转运相关基因的表达;与2D培养和球状模型下的化学物质肝毒性评估结果相比,该模型通过检测三磷酸腺苷(adenosine 5’-triphosphate, ATP)和白蛋白指标识别出了其他2类模型没有识别到的肝毒性化学物质,具有更高的灵敏性。然而,3D生物打印仍然存在一些有待改进的地方,如细胞与生物相容性材料之间的兼容性差,打印速度低,打印后可能会由于培养环境的失控导致支架形状发生改变。为了解决这些问题,新一代的3D生物打印方法也在不断的发展中[16],例如,一种四维(4D)生物打印新技术被提出,第四维指的是3D生物打印生成的构造在打印后随着时间的推移继续被控制发展[42]。
2 3D体外培养模型在环境化学物质肝毒性预测中的应用(Application of 3D in vitro culture models on hepatotoxicity prediction of environmental chemicals)
环境化学物质肝毒性评估按暴露时间主要分为短期暴露(12 h或24 h)产生的肝细胞毒性(例如50%受抑制浓度(IC50)),与长期暴露(数周或数月)引起的肝特有毒性(例如肝纤维化或脂肪肝)[43]。目前3D肝细胞体外测试模型在环境化学物质肝毒性尤其是慢性肝毒性评估方面的应用逐渐增加,表2罗列了3D体外培养模型在环境化学物质引发肝毒性的预测中的应用案例,包括纳米材料、持久性有机污染物(四氯二苯并-对-二噁英(TCDD)、3,3’,4,4’,5-五氯联苯(PCB126)等)和新型有机污染物等(全氟辛酸(PFOA)等)。
2.1 纳米材料
3D肝细胞体外培养模型可有效控制纳米材料的暴露方式,为研究纳米材料在体外肝细胞功能稳定情况下的毒性效应提供测试平台,且目前在纳米材料肝毒性评估中应用较多的是球形模型和流动状态的芯片模型。随着纳米材料在医药、个人护理品及电子产品等多个领域的大量应用[56],纳米材料存在广泛的环境暴露与生物内暴露,严重威胁生态环境及人体健康安全[57]。尽管目前纳米材料的环境健康风险研究已经取得了较多的进展,但是仍然存在许多亟待解决的问题和挑战。其中,由于纳米材料的毒性效应受多种因素(元素组成、尺寸和表面电荷等)的影响,传统的化学药品毒性测试方法不适用于纳米材料毒性机制评估[58],因此,需要发展针对纳米材料环境健康风险评估的新方法或者替代测试策略。Li等[44]构建了一个用于评估纳米材料肝毒性的微流控3D肝细胞芯片模型,该模型通过连续灌注的方式研究纳米材料累积暴露的毒性。超顺磁性氧化铁纳米粒子在该模型下表现出比标准的2D孔板暴露方式更强的肝毒性,可能的原因是较小尺寸的纳米粒子在此模型下更有可能与肝细胞发生作用,影响白蛋白和尿素的合成路径,最终引发更严重的肝损伤。Jiang等[45]利用大鼠肝细胞球状体研究了硫化铜纳米粒子的肝毒性及其机制,发现硫化铜纳米粒子通过影响线粒体膜电位以及诱导细胞产生氧化应激从而引起肝毒性,同时还发现硫化铜纳米粒子影响胆盐输出泵的转录和表达,对肝脏胆汁的转运进行阻断,但是具体的机理还有待进一步的研究。
表2 3D体外培养模型在化学物质肝毒性预测方面的应用案例
Table 2 Application cases of 3D in vitro culture models for hepatoxicity prediction of environmental chemicals

3D模型3D models细胞类型Cell types化学物质Chemicals测试时间Testing time测试浓度Testing concentration测试终点Testing endpoints参考文献References微流控3D肝细胞芯片A microfluidic 3D hepatocyte chip原代大鼠肝细胞Primary rat hepatocytes超顺磁性氧化铁纳米粒子Superparamagnetic iron oxide nanoparticles3 d (短期)3 d (short term) 7 d (长期)7 d (long term)50, 100, 200 mg·L-1白蛋白合成、尿素分析、细胞毒性测试Albumin and urea assays;cytotoxicity[44]球形模型Spheroid model原代大鼠肝细胞Primary rat hepatocytes硫化铜纳米颗粒Copper sulfide nanoparticles15 d (长期)15 d (long term)50, 100, 200 mg·L-1肝细胞活力、形态、线粒体膜电位、活性氧和肝胆转运体Cell viability/morphology, mitochondrial membrane potential & oxidative stress, hepatobiliary transporter activity[45]球形模型Spheroid modelHepG2纳米材料(TiO2、Ag、ZnO)Nanoparticles (TiO2, Ag, ZnO)24 h3~212 mg·L-1细胞毒性、DNA损伤Cytotoxicity, DNA damage[46]球形模型Spheroid modelHepaRG/THP-1/肝星状细胞(HSCs)HepaRG/THP-1/hepatic stellate cells (HSCs)BaP、TCDD、PCB12614 d1×10-7~5 mg·L-1细胞毒性、肝纤维化指标Cytotoxicity, liver fibrosis [47]球形模型Spheroid model鸡肝癌细胞(LMH)Chicken hepatocellular carcinoma cell line (LMH)PCB12624 h3.26×10-5~3.26×10-2 mg·L-1细胞毒性、EROD活性Cytotoxicity, EROD assay [48]球形模型Spheroid model原代水牛肝细胞Primary buffalohepatocyteTCDD24 h2×10-7~2×10-5 mg·L-1基因表达Gene expression[49]球形模型Spheroid model小鼠肝细胞(AML12)Mouse liver cells (AML12)PFOA、HFPO-DA、PFO4DA28 d20.7, 41.4, 82.8 mg·L-1细胞毒性、肝特有的功能Cytotoxicity, liver specific function[50]微型芯片Micro-pillar/micro-well chipHep3B人肝癌细胞Hep3B human hepatoma cells双酚A(BPA)Bisphenol A (BPA)24 h2.28~570 mg·L-1细胞毒性Cytotoxicity[9]球形模型Spheroid modelHepG2双酚A(BPA)Bisphenol A (BPA)24 h1.14, 4.56 mg·L-1基因表达Gene expression[51]器官芯片Organ on chip大鼠原代肝细胞Primary rat hepatocytes滴滴涕(DDT)、氯菊酯(PMT)、DDT/PMT混合物Dichlorodiphenyl-trichloroethane (DDT), permethrin (PMT), mixtures of DDT/PMT 48 h5.31, 53.1 mg·L-1基因表达、内源代谢产物Gene expression, endogenous metabolites[52]球形模型Spheroid model鸡肝癌细胞(LMH)Chicken hepatocellular carcinoma cell line (LMH)BaP8, 24, 35, 48 h0.025~25.1 mg·L-1cyp1a1以及DNA损伤基因表达Gene expression related to cyp1a1 or DNA damage [53]

3D模型3D models细胞类型Cell types化学物质Chemicals测试时间Testing time测试浓度Testing concentration测试终点Testing endpoints参考文献References球形模型Spheroid modelHepaRG11个基因毒性化学物质11 genotoxicity chemicals 24, 48 h0.013~442.08 mg·L-1DNA损伤DNA damage[54]流体芯片Fluidic chip大鼠原代肝细胞/肝星状细胞(HSCs)Rat primary hepatocytes and hepatic stellate cells (HSCs)酒精Alcohol48 h15.78~63.12 mg·L-1细胞毒性、肝功能测试Cytotoxicity, liver function[55]
注:BaP表示苯并芘;TCDD表示四氯二苯并-对-二噁英;PCB126表示3,3’,4,4’,5-五氯联苯;PFOA表示全氟辛酸;HFPODA表示六氟环氧丙烷二聚酸;PFO4DA表示全氟-3,5,7,9-四氧杂癸酸;EROD表示7-乙氧基-异吩唑酮-脱乙基酶。
Note: BaP stands for benzo[a]pyrene; TCDD stands for tetrachlorodibenzo-p-dioxin; PCB126 stands for 3,3’,4,4’,5-pentachlorobiphenyl; PFOA stands for perfluorocaprylic acid; HFPODA stands for hexafluoropropylene oxide dimer acid; PFO4DA stands for perfluoro-3,5,7,9-tetraoxadecanoic acid; EROD stands for 7-ethoxyresorufin-O-deethylase.
不同的纳米材料在3D肝细胞体外培养模型下的肝毒性效应与2D培养模型下的结果相比较,敏感性不同,但3D培养模型下的肝毒性效应更能真实地反映纳米材料体内暴露的毒性。Elje等[46]对比了HepG2细胞在3D球形培养和2D培养下对纳米二氧化钛、纳米银以及纳米氧化锌的毒性响应,包括细胞毒性和基因毒性;发现弱毒性的纳米二氧化钛在2个模型下都没有表现出毒性效应,强毒性的纳米氧化锌表现出相似的细胞毒性,但是纳米银对2D培养下的HepG2细胞具有更强的毒性,这些差异的来源可能是由于纳米材料暴露方式的不同影响了其毒性效应。尽管纳米材料的肝毒性在3D培养模型下与2D培养存在差异,但是3D培养模型下的肝毒性数据与体内测试结果有着更好的一致性[59]。因此,开发并使用能够模拟体内暴露环境的3D培养模型进行纳米材料的人体健康风险评估非常重要。
2.2 持久性有机污染物
3D肝细胞模型为研究持久性有机污染物(POPs)对人体肝脏的影响提供了一个接近于体内肝脏功能且能够研究低浓度长期暴露毒性效应的测试平台,这增加了利用体外模型的毒性数据预测POPs人体健康风险的可信度。二噁英(TCDD)和多氯联苯(PCB126)是2种典型的持久性有机污染物,同时是芳香烃受体(AhR)的配体[60],由于AhR受体的结构以及AhR信号通路响应在动物与人体之间具有差异,且AhR受体在TCDD、PCB126致毒过程中发挥着重要作用,因此TCDD、PCB126致毒机制及毒性效应存在物种差异[61]。在动物模型下,TCDD、PCB126与AhR受体结合,激活AhR信号通路,产生大量的细胞色素酶,长期暴露导致细胞氧化应激和炎症反应增强,肝细胞以及周围的肝非实质细胞的正常功能紊乱,导致脂肪肝、肝纤维化以及肝脏肿瘤的发生[62]。然而,Yan等[47]构建了一个由HepaRG、肝星状细胞(HSCs)和巨噬细胞(THP-1)共培养的人肝微组织模型,该模型能有效用于识别化学物质所引发的肝纤维化,并且观察到硫代乙酰胺(TAA)以及苯并芘(BaP)引起的肝纤维化。但在TCDD和PCB126胁迫下,并未观察到肝纤维化,仅检测到细胞色素酶等代谢相关信号的激活[27]。动物模型和人肝微组织模型测试结果的差异进一步预示着在评估POPs对人体肝脏危害时,需要考虑物种间的毒性差异。除了3D人肝微组织模型外,基于鸡肝癌细胞(LMH)以及原代水牛肝细胞的3D球状模型也分别用于评估PCB126和TCDD的毒性效应[48-49]。研究发现,PCB126在3D鸡肝癌细胞模型下的细胞毒性IC50值高于2D培养模型,但是在评估7-乙氧基-异吩唑酮-脱乙基酶(7-ethoxyresorufin-O-deethylase, EROD)活性以及AhR相关基因表达方面,PCB126在3D模型下诱导更高的基因表达以及EROD活性,这表明了3D培养模型在评估分子水平变化时具有灵敏度高的特点。以原代水牛肝细胞构建的3D肝细胞培养模型通过检测TCDD诱导的特有基因表达情况,并与已知的原代人肝细胞以及大鼠细胞测试结果做比较,发现该模型对TCDD的响应与原代人肝细胞模型更相似,这也说明了不同物种在响应TCDD毒性时存在物种差异,以及发展更接近于人体毒性响应模型的重要性[49]。总之,在评估化学物质对人体肝脏的影响时,建立与人体肝脏模型相关性高的3D体外细胞模型一方面可以在体外培养肝细胞的过程中保存肝细胞功能,另外一方面可以缩小毒性效应的物种差异,为环境化学物质的肝毒性评估提供接近于人体肝脏功能的测试平台。
2.3 新型有机污染物
3D肝细胞培养模型为新型有机污染物全氟辛酸(perflurooctanoic acid, PFOA)和双酚A (bisphenol A, BPA)的肝毒性机制研究提供了一个模拟体内暴露环境的平台,缩小了体外和体内研究结果的差异,弥补了传统2D细胞培养下肝细胞基因表达异常等不足。随着PFOA替代品的出现,为了提高PFOA及其替代品的毒性测试通量以及增加体外测试数据的准确性,利用3D肝细胞模型进行这类物质的肝毒性研究是一个可行的选择。在小鼠肝细胞(AML12)球形模型下,PFOA细胞毒性的IC50值比2D培养条件下的数值高,且氧化应激水平也具有同样的趋势,41.4 mg·L-1和82.8 mg·L-1 PFOA暴露AML12球状体28 d会导致细胞氧化应激、乳酸脱氢酶漏出率以及凋亡效应因子caspase3/7活性显著增加;六氟环氧丙烷二聚酸(hexafluoropropylene oxide dimer acid, HFPO-DA)和全氟-3,5,7,9-四氧杂癸酸(perfluoro-3,5,7,9-tetraoxadecanoic acid, PFO4DA)这2个新兴替代品也会引起细胞氧化应激以及细胞损伤,但比PFOA的肝毒性小[50]。
3D肝细胞体外培养模型在BPA肝毒性机制研究方面的应用提高了慢性BPA暴露肝毒性致毒机制的认识。HepG2球状体经BPA染毒14 d后的转录组变化显示,BPA影响与脂质代谢功能相关的生物过程,包括脂质生物合成、类固醇代谢过程和胆固醇调节过程,且这一结果与大鼠经BPA暴露90 d后的转录组变化情况相一致[51],补充了2D HepG2模型未检测到低浓度BPA暴露影响脂质代谢的不足[63]。另外,在基于人肝癌细胞Hep3B的微流控芯片模型中,BPA被证实在CYP2E1细胞色素酶存在的情况下毒性更强,而在乙醇脱氢酶、乙醛脱氢酶以及雌激素硫酸转移酶存在的情况下毒性减弱,同时该系统用到的酶样品体积仅为普通的96孔板的1/2 000,大大节约了该模型评估化学物质代谢毒性所需要的花费[9]。
2.4 其他环境化学物质
3D肝细胞模型可用于研究由农药暴露引起的肝脏代谢紊乱的毒性机制。在传统的2D细胞模型下,肝细胞的代谢能力会迅速减弱,这会影响农药肝脏毒性的预测,以及机制的研究。Jellali等[52]利用大鼠原代细胞构建的器官芯片和多组织学测试方法的结合研究了滴滴涕(dichlorodiphenyltrichloroethane, DDT)、氯菊酯(permethrin, PMT)和它们混合物引起的肝脏损害,转录组和代谢组测试结果共同表明,53.1 mg·L-1 DDT、58.7 mg·L-1 PMT和DDT/PMT混合物通过干扰与PPARα信号传导、脂质代谢和类固醇合成等相关基因而干扰脂肪酸、脂质以及葡萄糖的代谢,同时发现混合暴露会引起更加复杂的基因和代谢紊乱。
除了肝毒性之外,3D肝细胞模型也可以用于评估环境化学物质基因毒性,且比2D培养模型具有更好的灵敏性。Sharin等[53]对比了BaP在鸡肝癌细胞2D培养和3D球形培养下诱导的cyp1a表达量以及引发的DNA损伤响应;在3D模型下,EROD活性在暴露8 h后即可检测到且在暴露24 h达到最大值,比2D模型更早检测到,同时与DNA损伤响应相关的基因也更早地在3D细胞模型下被检测到,这说明了鸡肝癌细胞LDH球状体适用于评估需要CYP1A激活的化学物质的基因毒性。Mandon等[54]利用HepaRG细胞构建了一个用于评估化学物质基因毒性的肝细胞模型,该模型测试了11个基因毒性化学物质对HepaRG球状体染毒24 h和48 h后DNA损伤情况,并且彗星实验结果显示8个基因毒性化学物质被检测到具有损伤DNA的能力。尽管3D HepaRG球状体在预测化学物质遗传毒性方面是一个非常有潜力的模型,但是还需要进一步的实验来验证和提高该模型对化学物质致癌性的预测效果。
3 3D体外培养模型在肝毒性AOPs指导下的应用前景(Prospect of 3D in vitro culture models under the guide of hepatotoxicity AOPs)
3D体外培养模型不仅提高了环境化学物质关于肝细胞毒性数据的准确性,还为分析环境化学物质引发多种肝毒性有害结局(例如胆汁淤积、脂肪肝和肝纤维化)提供了复杂的体外细胞模型。肝毒性AOPs系统地描述了毒性发展过程,根据收录在AOP-wiki数据库中涉及到肝毒性的有害结局,肝毒性AOPs可以归纳为5种类型:肝脏肿瘤、肝纤维化、脂肪肝、胆汁淤积和肝细胞损伤。这些AOPs涉及到的生物信息有利于针对性地设置3D体外培养模型的检测指标,指导3D体外培养模型从分子、细胞、组织和器官水平对环境化学物质肝毒性进行评估,实现提高模型预测准确性的目标[64]。
不同的肝毒性终点测试需求决定了3D体外培养模型的选择。在预测环境化学物质对人体肝脏的影响时,选择基于人源细胞系的培养模型能够减少由物种差异带来的毒性信息不一致的可能性;而利用动物源肝细胞培养模型获得的化学物质毒性数据以及毒性机制信息同样为生态及健康风险评估提供了重要的理论依据。另外一方面,针对化学物质引起的肝纤维化、脂肪肝等肝脏毒性研究,由于毒性产生过程中多种细胞系受到影响且细胞系之间存在密切的相互作用,因此在评估这种类型的肝毒性时,多细胞系共培养模型更加符合化学物质毒性引发的场景。此外,3D体外培养模型可以评估环境化学物质低浓度长期暴露引起的肝脏损伤以及细胞内发生的分子机制,并结合现有的肝毒性AOPs预测环境化学物质对人体的影响。
3D体外肝细胞培养模型联合其他体外测试方法或者组学测试(转录组学、代谢组学、脂质组学与蛋白质组学)进一步提高了环境化学物质肝毒性预测的准确性[65]。导致肝脏毒性的过程会涉及到多种细胞参与,是一个机制比较复杂的过程。因此,目前单一模型或测试无法准确评估环境化学物质诱发肝损伤的风险。依据肝毒性机制构建一个包含多种或多级肝毒性测试方法的整合预测模型是毒性测试的发展方向[66]。这种整合预测方法由2个维度组成(图2),横向反映的是环境化学物质引发的肝毒性AOPs,纵向是整合测试评估方法(integrated approaches to testing and assessment, IATA)。环境化学物质引起肝毒性分子启动事件的发生是肝损伤的重要分子标志物之一,由于待测环境化学物质数量巨大,采用体外化学分析法(in chemico)或计算机模拟法(in silico)对分子启动事件的进行评估可以提高预测的规模和速度。具有引发分子启动事件潜力的那些环境化学物质将会进行第二级的肝毒性体外测试,主要是为了检测环境化学物质在细胞或组织水平是否能够引起肝毒性生物标志物的变化,这个过程涉及到的毒性机制更加复杂,因此3D体外肝细胞培养模型的应用为这一步的测试提供了更好的测试平台。如果环境化学物质在第二级同样被检测出有肝毒性风险,则需要进行第三级人群流行病学的调查,进一步确认该环境化学物质的肝毒性。
综上所述,3D体外肝细胞培养模型更好地模拟了真实肝脏的功能,并形成了以夹层培养法、球形模型、生物反应器、器官芯片和3D生物打印5种主要的3D细胞模型制备方法,其中球形模型在进行大量环境化学物质肝毒性预测方面应用时可以做到高通量,而生物器、器官芯片以及3D生物打印可以模拟更加复杂的体内肝脏环境。肝毒性AOPs总结了化学物质从(1)分子启动事件(cyp2e1持续激活、AhR持续激活、PPARα激活等),到(2)细胞、组织/器官水平上的分子响应关键事件(胆汁酸合成增加、脂质积累、炎症反应、肝星状细胞激活等),再到(3)个体水平上可观察到的肝损伤(肝脏肿瘤、肝纤维化和脂肪肝等),为充分利用3D体外肝细胞培养模型进行环境化学物质肝毒性预测提供了理论依据。另外,3D肝细胞模型可以与多种检测技术(如组学)结合,进一步提高对环境化学物质肝毒性预测的准确性。
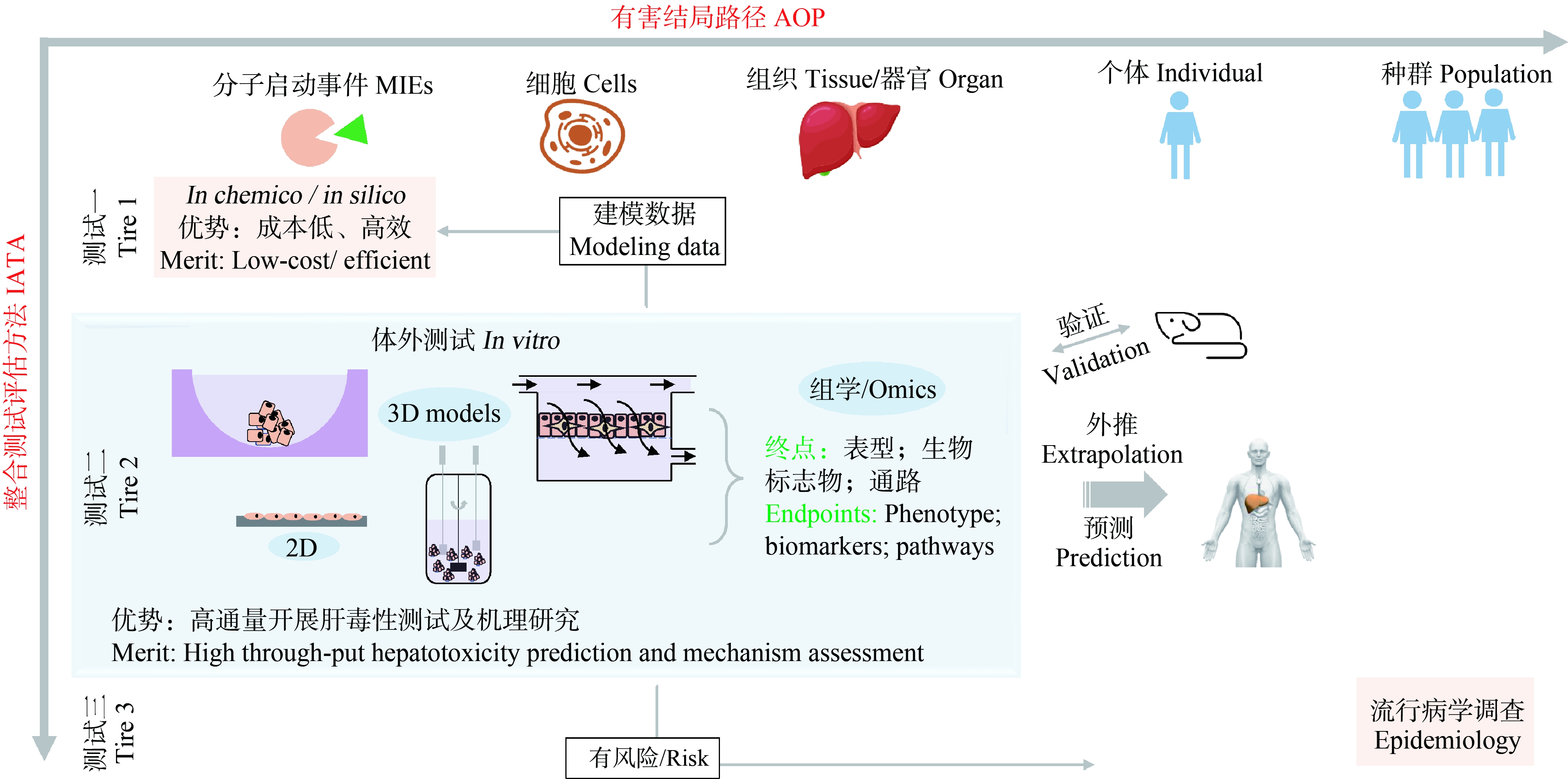
图2 有害结局路径指导下的肝毒性整合测试评估方法
注:AOP表示有害结局路径;IATA表示整合测试评估方法;MIEs表示分子启动事件。
Fig. 2 Integrated testing assessment approaches for hepatotoxicity guided by the adverse outcome pathway
Note: AOP stands for adverse outcome pathway; IATA stands for integrated approaches to testing and assessment;
MIEs stands for molecular initiating events.
通讯作者简介:张效伟(1978—),男,博士,教授,博士生导师,主要研究方向为生态毒理学和健康风险评估。
[1] Trefts E, Gannon M, Wasserman D H. The liver [J]. Current Biology, 2017, 27(21): R1147-R1151
[2] Ortega-Alonso A, Andrade R J. Chronic liver injury induced by drugs and toxins [J]. Journal of Digestive Diseases, 2018, 19(9): 514-521
[3] Tabernilla A, dos Santos Rodrigues B, Pieters A, et al. In vitro liver toxicity testing of chemicals: A pragmatic approach [J]. International Journal of Molecular Sciences, 2021, 22(9): 5038
[![]() A. Chemical topology and ecotoxicology [J]. The Science of the Total Environment, 1991, 109-110: 197-220
A. Chemical topology and ecotoxicology [J]. The Science of the Total Environment, 1991, 109-110: 197-220
[5] Treyer A, Müsch A. Hepatocyte polarity [J]. Comprehensive Physiology, 2013, 3(1): 243-287
[6] Lauschke V M, Hendriks D F, Bell C C, et al. Novel 3D culture systems for studies of human liver function and assessments of the hepatotoxicity of drugs and drug candidates [J]. Chemical Research in Toxicology, 2016, 29(12): 1936-1955
[7] Pampaloni F, Reynaud E G, Stelzer E H K. The third dimension bridges the gap between cell culture and live tissue [J]. Nature Reviews Molecular Cell Biology, 2007, 8(10): 839-845
[8] Ide I, Nagao, Kajiyama S, et al. A novel evaluation method for determining drug-induced hepatotoxicity using 3D bio-printed human liver tissue [J]. Toxicology Mechanisms and Methods, 2020, 30(3): 189-196
[9] Lee D W, Oh W Y, Yi S H, et al. Estimation of bisphenol A: Human toxicity by 3D cell culture arrays, high throughput alternatives to animal tests [J]. Toxicology Letters, 2016, 259: 87-94
[10] Leist M, Ghallab A, Graepel R, et al. Adverse outcome pathways: Opportunities, limitations and open questions [J]. Archives of Toxicology, 2017, 91(11): 3477-3505
[11] Horvat T, Landesmann B, Lostia A, et al. Adverse outcome pathway development from protein alkylation to liver fibrosis [J]. Archives of Toxicology, 2017, 91(4): 1523-1543
[12] de Bruyn T, Chatterjee S, Fattah S, et al. Sandwich-cultured hepatocytes: Utility for in vitro exploration of hepatobiliary drug disposition and drug-induced hepatotoxicity [J]. Expert Opinion on Drug Metabolism & Toxicology, 2013, 9(5): 589-616
[13] Ramaiahgari S C, den Braver M W, Herpers B, et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies [J]. Archives of Toxicology, 2014, 88(5): 1083-1095
[14] Palakkan A A, Raj D K, Rojan J, et al. Evaluation of polypropylene hollow-fiber prototype bioreactor for bioartificial liver [J]. Tissue Engineering Part A, 2013, 19(9-10): 1056-1066
[15] Choe A, Ha S K, Choi I, et al. Microfluidic gut-liver chip for reproducing the first pass metabolism [J]. Biomedical Microdevices, 2017, 19(1): 4
[16] Mazzocchi A, Soker S, Skardal A. 3D bioprinting for high-throughput screening: Drug screening, disease modeling, and precision medicine applications [J]. Applied Physics Reviews, 2019, 6(1): 011302
[17] Deharde D, Schneider C, Hiller T, et al. Bile canaliculi formation and biliary transport in 3D sandwich-cultured hepatocytes in dependence of the extracellular matrix composition [J]. Archives of Toxicology, 2016, 90(10): 2497-2511
[18] Chatterjee S, Richert L, Augustijns P, et al. Hepatocyte-based in vitro model for assessment of drug-induced cholestasis [J]. Toxicology and Applied Pharmacology, 2014, 274(1): 124-136
[19] Xu J J, Henstock P V, Dunn M C, et al. Cellular imaging predictions of clinical drug-induced liver injury [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2008, 105(1): 97-105
[20] Zeigerer A, Wuttke A, Marsico G, et al. Functional properties of hepatocytes in vitro are correlated with cell polarity maintenance [J]. Experimental Cell Research, 2017, 350(1): 242-252
[21] Yokoyama Y, Sasaki Y, Terasaki N, et al. Comparison of drug metabolism and its related hepatotoxic effects in HepaRG, cryopreserved human hepatocytes, and HepG2 cell cultures [J]. Biological & Pharmaceutical Bulletin, 2018, 41(5): 722-732
[22] Sison-Young R L, Mitsa D, Jenkins R E, et al. Comparative proteomic characterization of 4 human liver-derived single cell culture models reveals significant variation in the capacity for drug disposition, bioactivation, and detoxication [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2015, 147(2): 412-424
[23] Ramaiahgari S C, Ferguson S S. Organotypic 3D HepaRG liver model for assessment of drug-induced cholestasis [J]. Methods in Molecular Biology, 2019, 1981: 313-323
[24] Basharat A, Rollison H E, Williams D P, et al. HepG2 (C3A) spheroids show higher sensitivity compared to HepaRG spheroids for drug-induced liver injury (DILI) [J]. Toxicology and Applied Pharmacology, 2020, 408: 115279
[25] Gupta R, Schrooders Y, Hauser D, et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq [J]. Archives of Toxicology, 2021, 95(2): 573-589
[26] van Grunsven L A. 3D in vitro models of liver fibrosis [J]. Advanced Drug Delivery Reviews, 2017, 121: 133-146
[27] Prestigiacomo V, Weston A, Messner S, et al. Pro-fibrotic compounds induce stellate cell activation, ECM-remodelling and Nrf2 activation in a human 3D-multicellular model of liver fibrosis [J]. PLoS One, 2017, 12(6): e0179995
[28] Dash A, Simmers M B, Deering T G, et al. Hemodynamic flow improves rat hepatocyte morphology, function, and metabolic activity in vitro [J]. American Journal of Physiology Cell Physiology, 2013, 304(11): C1053-C1063
[29] Zeilinger K, Schreiter T, Darnell M, et al. Scaling down of a clinical three-dimensional perfusion multicompartment hollow fiber liver bioreactor developed for extracorporeal liver support to an analytical scale device useful for hepatic pharmacological in vitro studies [J]. Tissue Engineering Part C, Methods, 2011, 17(5): 549-556
[30] Darnell M, Ulvestad M, Ellis E, et al. In vitro evaluation of major in vivo drug metabolic pathways using primary human hepatocytes and HepaRG cells in suspension and a dynamic three-dimensional bioreactor system [J]. The Journal of Pharmacology and Experimental Therapeutics, 2012, 343(1): 134-144
[31] Prill S, Bavli D, Levy G, et al. Real-time monitoring of oxygen uptake in hepatic bioreactor shows CYP450-independent mitochondrial toxicity of acetaminophen and amiodarone [J]. Archives of Toxicology, 2016, 90(5): 1181-1191
[32] Mastrangeli M, Millet S, Orchid Partners T, et al. Organ-on-chip in development: Towards a roadmap for organs-on-chip [J]. ALTEX, 2019, 36(4): 650-668
[33] 孙威, 陈雨晴, 罗国安, 等. 器官芯片及其应用[J]. 分析化学, 2016, 44(4): 533-541
Sun W, Chen Y Q, Luo G A, et al. Organs-on-chips and its applications [J]. Chinese Journal of Analytical Chemistry, 2016, 44(4): 533-541 (in Chinese)
[34] Ehrlich A, Duche D, Ouedraogo G, et al. Challenges and opportunities in the design of liver-on-chip microdevices [J]. Annual Review of Biomedical Engineering, 2019, 21: 219-239
[35] Nguyen D G, Funk J, Robbins J B, et al. Bioprinted 3D primary liver tissues allow assessment of organ-level response to clinical drug induced toxicity in vitro [J]. PLoS One, 2016, 11(7): e0158674
[36] Rennert K, Steinborn S, Gröger M, et al. A microfluidically perfused three dimensional human liver model [J]. Biomaterials, 2015, 71: 119-131
[37] Cavero I, Guillon J M, Holzgrefe H H. Human organotypic bioconstructs from organ-on-chip devices for human-predictive biological insights on drug candidates [J]. Expert Opinion on Drug Safety, 2019, 18(8): 651-677
[38] Murphy S V, Atala A. 3D bioprinting of tissues and organs [J]. Nature Biotechnology, 2014, 32(8): 773-785
[39] Odde D J, Renn M J. Laser-guided direct writing for applications in biotechnology [J]. Trends in Biotechnology, 1999, 17(10): 385-389
[40] Xu T, Jin J, Gregory C, et al. Inkjet printing of viable mammalian cells [J]. Biomaterials, 2005, 26(1): 93-99
[41] Ozbolat I T, Hospodiuk M. Current advances and future perspectives in extrusion-based bioprinting [J]. Biomaterials, 2016, 76: 321-343
[42] Gao B, Yang Q Z, Zhao X, et al. 4D bioprinting for biomedical applications [J]. Trends in Biotechnology, 2016, 34(9): 746-756
[43] Jiang J, Pieterman C D, Ertaylan G, et al. The application of omics-based human liver platforms for investigating the mechanism of drug-induced hepatotoxicity in vitro [J]. Archives of Toxicology, 2019, 93(11): 3067-3098
[44] Li L, Gokduman K, Gokaltun A, et al. A microfluidic 3D hepatocyte chip for hepatotoxicity testing of nanoparticles [J]. Nanomedicine, 2019, 14(16): 2209-2226
[45] Jiang T Y, Guo H X, Xia Y N, et al. Hepatotoxicity of copper sulfide nanoparticles towards hepatocyte spheroids using a novel multi-concave agarose chip method [J]. Nanomedicine, 2021, 16(17): 1487-1504
[46] Elje E, Mariussen E, Moriones O H, et al. Hepato(geno)toxicity assessment of nanoparticles in a HepG2 liver spheroid model [J]. Nanomaterials, 2020, 10(3): E545
[47] Yan L, Messner C J, Zhang X W, et al. Assessment of fibrotic pathways induced by environmental chemicals using 3D-human liver microtissue model [J]. Environmental Research, 2021, 194: 110679
[48] Sharin T, Crump D, O’Brien J M. Evaluation of the aryl hydrocarbon receptor response in LMH 3D spheroids [J]. Environmental Toxicology and Chemistry, 2020, 39(9): 1693-1701
[49] Goud E S K, Pandey M, Singh C, et al. Effect of dioxins in milk on the 3D cultured primary buffalo hepatocyte model system [J]. Journal of Agricultural and Food Chemistry, 2019, 67(28): 8007-8019
[50] Sun S J, Guo H, Wang J S, et al. Hepatotoxicity of perfluorooctanoic acid and two emerging alternatives based on a 3D spheroid model [J]. Environmental Pollution, 2019, 246: 955-962
[51] Kim B Y, Kim M, Jeong J S, et al. Comprehensive analysis of transcriptomic changes induced by low and high doses of bisphenol A in HepG2 spheroids in vitro and rat liver in vivo [J]. Environmental Research, 2019, 173: 124-134
[52] Jellali R, Jacques S, Essaouiba A, et al. Investigation of steatosis profiles induced by pesticides using liver organ-on-chip model and omics analysis [J]. Food and Chemical Toxicology, 2021, 152: 112155
[53] Sharin T, Gyasi H, Jones S P, et al. Concentration- and time-dependent induction of Cyp1a and DNA damage response by benzo(a)pyrene in LMH three-dimensional spheroids [J]. Environmental and Molecular Mutagenesis, 2021, 62(5): 319-327
[54] Mandon M, Huet S, Dubreil E, et al. Three-dimensional HepaRG spheroids as a liver model to study human genotoxicity in vitro with the single cell gel electrophoresis assay [J]. Scientific Reports, 2019, 9(1): 10548
[55] Lee J, Choi B, da Yoon No, et al. A 3D alcoholic liver disease model on a chip [J]. Integrative Biology, 2016, 8(3): 302-308
[56] Elder A, Vidyasagar S, DeLouise L. Physicochemical factors that affect metal and metal oxide nanoparticle passage across epithelial barriers [J]. Wiley Interdisciplinary Reviews Nanomedicine and Nanobiotechnology, 2009, 1(4): 434-450
[57] Meesters J A J, Quik J T K, Koelmans A A, et al. Multimedia environmental fate and speciation of engineered nanoparticles: A probabilistic modeling approach [J]. Environmental Science: Nano, 2016, 3(4): 715-727
[58] Kaundal B, Dalai S, Choudhury S R. Nanomaterial Toxicity in Microbes, Plants and Animals [M]//Sustainable Agriculture Reviews. Cham: Springer International Publishing, 2017: 243-266
[59] Lee J, Lilly G D, Doty R C, et al. In vitro toxicity testing of nanoparticles in 3D cell culture [J]. Small, 2009, 5(10): 1213-1221
[60] Vezina C M, Walker N J, Olson J R. Subchronic exposure to TCDD, PeCDF, PCB126, and PCB153: Effect on hepatic gene expression [J]. Environmental Health Perspectives, 2004, 112(16): 1636-1644
[61] Kovalova N, Nault R, Crawford R, et al. Comparative analysis of TCDD-induced AhR-mediated gene expression in human, mouse and rat primary B cells [J]. Toxicology and Applied Pharmacology, 2017, 316: 95-106
[62] Li C Y, Liu Y Y, Dong Z, et al. TCDD promotes liver fibrosis through disordering systemic and hepatic iron homeostasis [J]. Journal of Hazardous Materials, 2020, 395: 122588
[63] Yue S Q, Yu J, Kong Y, et al. Metabolomic modulations of HepG2 cells exposed to bisphenol analogues [J]. Environment International, 2019, 129: 59-67
[64] Gijbels E, Vilas-Boas V, Annaert P, et al. Robustness testing and optimization of an adverse outcome pathway on cholestatic liver injury [J]. Archives of Toxicology, 2020, 94(4): 1151-1172
[65] Dragovic S, Vermeulen N P, Gerets H H, et al. Evidence-based selection of training compounds for use in the mechanism-based integrated prediction of drug-induced liver injury in man [J]. Archives of Toxicology, 2016, 90(12): 2979-3003
[66] Tollefsen K E, Scholz S, Cronin M T, et al. Applying adverse outcome pathways (AOPs) to support integrated approaches to testing and assessment (IATA) [J]. Regulatory Toxicology and Pharmacology, 2014, 70(3): 629-640